Ligand je esencijalna komponenta kompleksnih proteina. Funkcija proteina
Ligandi - To su supstance sposobne da se specifično vežu za aktivni centar molekula određene strukture.
Bioligandi Predlažem da imenujem one ligande koji provode bioregulaciju u živim organizmima zbog njihovog vezivanja za ciljne receptorske molekule. (© Sazonov V.F., 2012. © kineziolog.bodhy.ru, 2012.)
Ligandi u bioregulaciji (bioligandi) su zapravo signalne kontrolne supstance sposobne da prenose kontrolne komande zbog njihovog vezivanja za aktivni centar molekularnih receptora koji imaju specifičnost za njih.
Dakle, možemo to tačno reći bioligandi izvršiti hemoregulacija , tj. hemijska kontrola ćelija, organizma, njegovih delova ili skupa organizama.
Mehanizam djelovanja bioliganda
Prema učinku liganda na konformaciju proteina, interakcije protein-ligand se mogu podijeliti u nekoliko klasa.
Interakcije klase I:
Ligand, vezujući se za protein, ne uzrokuje značajne promjene u konformaciji, ali stabilizira strukturu proteina.
Primjer je vezivanje Ca2* jona sa lizozimom. U prisustvu liganda (Ca2" jona), denaturacija lizozima zahtijeva visoke koncentracije odgovarajućeg agensa (uree ili gvanidin hidroklorida).
Očigledno, u ovom slučaju, uz pomoć Ca2< образуются дополнительные связи между радикалами.
Interakcije klase II:
Ligand značajno mijenja tercijarnu strukturu proteina i tek u tom stanju protein postaje dovoljno aktivan.
Primjer je vezivanje Ca2* jona sa kalmodulinom, intracelularnim receptorom za ove jone. Vezivanjem dva Ca2* jona, kalmodulin stiče sposobnost da utiče na aktivnost mnogih ćelijskih proteina.
Interakcije klase III:
U nedostatku liganda, protein je u tzv. stanje rastopljene globule: ima prilično kompaktan globularni oblik, ali bez ikakve određene tercijarne strukture - potonja se formira samo kada je ligand vezan.
Primjer takvog proteina je laktalbumin (komponenta kompleksa enzima za sintezu laktoze). To je mali protein koji sadrži 4 disulfidne veze i snažno veže 1 Ca* ion. Očigledno, ovaj ion je ključni element koji formira strukturu. Kada se ukloni, tercijarna struktura proteina je uništena. Ali globularni oblik i veličina globule su očuvani zbog stabilizacijskog efekta disulfidnih veza.
Interakcije klase IV:
Bez liganda, sekundarna struktura proteina nije u potpunosti formirana, a tercijarna struktura je potpuno odsutna. U ovom slučaju, peptidni lanac se djelomično odvija.
Primjer proteina osteokalcina, koji se nalazi u koštanom matriksu. Sadrži samo oko 50 aminokiselinskih ostataka i sposoban je da veže 5 Ca jona. "Vezivanje je praćeno značajnim smanjenjem volumena globule, formiranjem tercijarne strukture i ujedinjenjem globula u dimere. u ovom slučaju, ligand je neophodan za pojavu kvartarne strukture u proteinu.
Interakcije klase V:
U nedostatku liganda, proteinski lanac se gotovo potpuno odvija, odnosno radi se o nasumičnom kolutu. Interakcija sa ligandom dovodi do potpunog formiranja prostorne strukture proteina.
Primjer je citokrom c, jedan od proteina u lancu transporta elektrona u mitohondrijima. Njegov ligand hem (slično hemoglobinu). Uklanjanje teme dovodi do skoro potpunog odvijanja proteinske molekule.
Interakcije klase VI:
Vezivanje liganda uzrokuje velike pomake proteinskih domena ili podjedinica.
Primjer je interakcija hemoglobina (Hb) s kisikom. Tokom ovog procesa dolazi do brojnih i složenih konformacionih transformacija. Uključujući susjedne podjedinice rotiraju jedna u odnosu na drugu za 10 15 ".
Kao rezultat toga, kada se molekula 02 veže za hem jedne podjedinice, povećava se afinitet prema kisiku susjednih podjedinica. Ovo se naziva kooperativnim efektom i od velike je fiziološke važnosti.
Zaključujući ovu tačku, daćemo dve napomene:
a) prvo, kao što vidite, ligandi zaista mogu veoma značajno uticati na konformaciju proteina;
b) drugo, za protein koji ima nekoliko liganada (posebno ako se potonji vežu za različite dijelove molekule), priroda takvog efekta za različite ligande može biti potpuno različita.
Na primjer, takvi ligandi kao što su hem i kisik imaju različite učinke na strukturu hemoglobina.
Stoga, za razliku od autora sistematizacije koja je ovdje navedena (V.N. Uversky i N.V. Narizhneva), nismo govorili o klasama proteina, već o klasama interakcija protein-ligand.
Ili radikali povezani sa centrom. atom kompleksnog jedinjenja. Oni m. B. joni (N -, Hal -, NO 3 -, NCS - i drugi), neorganski. molekule (H 2, C n, N 2, P n, O 2, S n, CO, CO 2, NH 3, NO, SO 2, NO 2, COS, itd.), org. Comm., koji sadrži elemente glavnih podgrupa V, VI, VII gr. periodično sistemi ili funkcija p-donora. Velika grupa L.-biološki važnih Comm. (, peptidi, purini, korini,) i njihova sintetika. analozi (kraun eteri,), kao i sa donorskim atomima i helatnim grupama. L. se može povezati sa centrom. atomske s-, p- i d-dvocentrične ili multicentrične veze. U slučaju formiranja dvocentričnih veza u litiju, mogu se razlikovati donorski centri (obično atomi N, O, S, Cl ili). Multicentrično vezivanje se vrši zahvaljujući p-aromatičnom sistemu. L. (, ciklopentadienid anion) ili heteroaromatični. L. (, tiofen, metilpiridini). Najvažnije količine. karakteristika donorsko-akceptorske sposobnosti L. - stomatologija, određena brojem donorskih centara L., koji učestvuju u koordinaciji. Po ovom osnovu L. se dijele na mono-, di-, ... polidentate. Koordinator. broj kompleksirajućih agenasa za monodentatne L. poklapa se sa njihovim brojem, za druge je jednak proizvodu broja L. po njihovoj denticiji. Priroda L. određuje tipove koordinacije. conn. (, amino kompleksi, mol. adukti, kelati, p-kompleksi, itd.); sv-va, struktura i reakcija zavise od toga. sposobnost složenih veza. i mogućnost njihove praktične. aplikacija. Lit .: Garnevsky A. D., "Zbornik radova visokoškolskih ustanova, Ser. Hemija i hemijska tehnologija". 1987, tom 30, c. 10, str. 3-16; "Koord.", 1988, tom 14, c. 5, str. 579-99; Sveobuhvatna koordinaciona hemija, v. 2-ligandi, Oksf 1987. A.D. Garnovsky.
Hemijska enciklopedija. - M .: Sovjetska enciklopedija. Ed. I. L. Knunyants. 1988 .
Pogledajte šta su "LIGANDI" u drugim rječnicima:
- (od latinskog ligo I vezujem) u kompleksnim jedinjenjima, molekulima ili jonima povezanim sa centralnim atomom (sredstvo za stvaranje kompleksa), na primer. u vezniku LIGATURA (kasnolatinska ligatura veza) 1) slovo ili fonetski transkripcijski znak nastao od ... ... Veliki enciklopedijski rječnik
ligandi- (dodaje) - joni, radikali ili neutralni molekuli koji se nalaze oko centralnog jona (atoma) kao rezultat formiranja koordinacione veze. Opća hemija: udžbenik / A. V. Zholnin ... Hemijski pojmovi
- (od latinskog ligo I vezujem), u kompleksnim jedinjenjima, molekulima ili ionima povezanim sa centralnim atomom (sredstvo za stvaranje kompleksa), na primer, u jedinjenju Cl3, centralnom atomu Co i ligandima molekule NH3. * * * LIGANDI LIGANDE (od lat. Ligo ... enciklopedijski rječnik
- (od latinskog ligo I vezujem) u kompleksnim jedinjenjima (vidi Kompleksna jedinjenja) molekuli ili joni direktno vezani za centralni atom; isto kao i dodaci... Velika sovjetska enciklopedija
- (od lat. ligo spajam), u složenom sos. molekule ili ioni povezani sa centrom, atomom (sredstvo za stvaranje kompleksa), na primjer. in conn. [Co (NH3) 6] C13 centar. atom Co i L. molekule NH3 ... Prirodna nauka. enciklopedijski rječnik
- ... Wikipedia
Ligandi- (lat. ligo - spajam). Specifične endogene supstance koje pobuđuju određene tipove ćelijskih moždanih receptora - adrenergičke, dopaminergičke, kolinergičke, serotonergičke, benzodiazepinske, peptidergičke itd. Eksplanatorni rječnik psihijatrijskih pojmova
ligandi- lige Anda, s, jedinice. h. ande, i ... Ruski pravopisni rječnik
Ligandi- (latinski ligo bind) endogene supstance koje su neurotransmiteri u sinapsama mozga (dopamin, acetilholin, serotonin, itd.). Psihotropni lijekovi i halucinogeni također imaju neka svojstva liganda. * * * Biološki ... ... Enciklopedijski rečnik psihologije i pedagogije
aksijalni ligandi- ašiniai ligandai statusas T sritis chemija apibrėžtis Vienoje ašyje esantys ligandai. atitikmenys: angl. aksijalni ligandi rus. aksijalni ligandi ryšiai: sinonimas - aksialiniai ligandai ... Chemijos terminų aiškinamasis žodynas
Knjige
- Imunološki problemi apoptoze, A. Yu. Baryshnikov, Yu. V. Shishkin. Posljednju deceniju obilježilo je burno proučavanje procesa programirane ćelijske smrti (apoptoze). Površinski ćelijski receptori i njihovi ligandi koji posreduju...
Glavno svojstvo proteina koje osigurava njegovu funkciju je njegova selektivna interakcija s određenom tvari - ligandom.
Ligandi mogu biti tvari različite prirode, kako jedinjenja male molekularne težine tako i makromolekule, uključujući proteine. Na proteinskim molekulima postoje mjesta za koja je vezan ligand - mjesta vezivanja ili aktivna mjesta. Vezna mjesta se formiraju od aminokiselinskih ostataka koji se spajaju kao rezultat formiranja sekundarne i tercijarne strukture.
Veze između proteina i liganda mogu biti nekovalentne i kovalentne. Visoka specifičnost interakcije (“prepoznavanje”) proteina i liganda je obezbeđena komplementarnošću strukture centra vezivanja sa prostornom strukturom liganda.
Komplementarnost se shvata kao hemijska i prostorna korespondencija između aktivnog mesta proteina i liganda. Interakcija između proteina P i liganda L opisuje se jednadžbom:
protein + ligand protein-ligand kompleks.
1. Glavna fizičko-hemijska svojstva proteina su molekularna težina, električni naboj i rastvorljivost u vodi. Molekularna težina proteina može značajno varirati. Na primjer, hormon inzulin ima molekularnu težinu od oko 6 hiljada Da, a imunoglobulin M - oko 1 milion Da. Molekularna težina proteina ovisi o broju aminokiselinskih ostataka koji čine njegov sastav, kao i o masi ne-aminokiselinskih komponenti. Prosječna težina jednog aminokiselinskog ostatka je 110 Da. Dakle, znajući broj aminokiselinskih ostataka u proteinu, može se procijeniti njegova molekularna težina i obrnuto (N.N. Mushkambarov, 1995). Električni naboj proteina određen je omjerom pozitivno i negativno nabijenih grupa na površini njegove molekule. Naboj proteinske čestice zavisi od pH sredine. Termin "izoelektrična tačka" koristi se za karakterizaciju proteina. Izoelektrična tačka (pI) je pH vrijednost medija pri kojoj je ukupni naboj proteinske čestice nula. Na izoelektričnoj tački, proteini su najmanje stabilni u rastvoru i lako se talože. Vrijednost pI ovisi o odnosu kiselih i bazičnih aminokiselina u proteinu. Za proteine i peptide u kojima dominiraju kisele aminokiseline (negativno nabijene pri pH 7,0), pI vrijednost je u kiseloj sredini; za proteine i peptide sa dominacijom bazičnih aminokiselina (pozitivno nabijene pri pH 7,0), pI vrijednost je u kiseloj sredini. Izoelektrična tačka je karakteristična konstanta proteina, njena vrijednost za većinu proteina životinjskih tkiva kreće se od 5,5 do 7,0, što ukazuje na prevlast kiselih aminokiselina u njihovom sastavu. Međutim, u prirodi postoje proteini u kojima vrijednost izoelektrične točke leži na ekstremnim pH vrijednostima medija. Konkretno, pI vrijednost pepsina (enzim želučanog soka) je 1, u lizozimu (enzim koji razgrađuje ćelijski zid mikroorganizama) - oko 11. Vrijednosti molekulske težine i izoelektrične točke nekih proteina prikazani su u tabeli 1.4. Tabela 1.4 Neke konstante proteina krvne plazme i tkiva
Rastvorljivost proteina u vodi. Iz kursa biofizičke hemije poznato je da proteini kao visokomolekularna jedinjenja formiraju koloidne rastvore. Stabilnost proteinskih rastvora u vodi određena je sledećim faktorima:
Imajte na umu da pod uticajem različitih fizičkih i hemijskih faktora može doći do taloženja proteina iz koloidnih rastvora. razlikovati:
Imajte na umu da se reakcije taloženja proteina mogu zasnivati na sljedećim mehanizmima:
Najčešće, djelovanje faktora koji izazivaju precipitaciju proteina karakterizira kombinacija dva ili sva tri ova mehanizma. Biološka aktivnost. Funkcioniranje bilo kojeg proteina temelji se na njegovoj sposobnosti selektivne interakcije sa strogo definiranim molekulima ili ionima - ligandima. Na primjer, za enzime koji kataliziraju kemijske reakcije, ligandi će biti tvari koje učestvuju u tim reakcijama (supstrati), kao i kofaktori, aktivatori i inhibitori. Za transportne proteine, ligandi su transportne supstance itd. Ligand je u stanju da stupi u interakciju sa specifičnim dijelom proteinske molekule - veznim centrom ili aktivnim centrom. Ovaj centar formiraju prostorno bliski radikali aminokiselina na nivou tercijarne strukture proteina. Sposobnost liganda da stupi u interakciju sa centrom vezivanja je zbog njihove komplementarnosti, odnosno međusobne komplementarnosti njihove prostorne strukture (slično interakciji "ključ-brava"). Nekovalentne (vodikove, jonske, hidrofobne) veze se formiraju između funkcionalnih grupa liganda i mesta vezivanja. Komplementarnost liganda i mjesta vezivanja može objasniti visoku specifičnost (selektivnost) interakcije protein - ligand. Dakle, različiti proteini se međusobno razlikuju po svojim fizičko-hemijskim svojstvima i biološkoj aktivnosti. Metode za razdvajanje proteinskih mješavina na frakcije i izolaciju pojedinačnih enzimskih proteina zasnivaju se na ovim razlikama. Ove metode se široko koriste u medicinskoj biohemiji i biotehnologiji. 2. Denaturacija proteina- ovo je promjena prirodnih (prirodnih) fizičko-hemijskih i, što je najvažnije, bioloških svojstava proteina zbog kršenja njegove kvartarne, tercijarne, pa čak i sekundarne strukture. Denaturacija proteina može biti uzrokovana:
Denaturirane proteine karakteriziraju:
Imajte na umu da je pod određenim uvjetima moguće vratiti izvornu (nativnu) konformaciju proteina nakon uklanjanja faktora koji je uzrokovao denaturaciju. Ovaj proces se zove odricanje. Sjetite se nekih primjera upotrebe procesa denaturacije proteina u medicini:
|
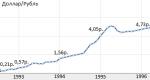
4 (1). Hemoglobin je alosterični protein. Konformacijske promjene u molekulu hemoglobina. Kooperativni efekat. Regulatori afiniteta hemoglobina za kiseonik. Strukturne i funkcionalne razlike u mioglobinu i hemoglobinu.
Hemoglobin: alosterični protein
Prijelaz u procesu evolucije s monomernog mioglobina na tetramerni hemoglobin bio je popraćen pojavom novih svojstava. Molekul hemoglobina je mnogo složeniji od molekula mioglobina. Prije svega, hemoglobin, osim 0 2, prenosi H + i C0 2. Drugo, vezivanje kiseonika hemoglobinom je regulisano specifičnim komponentama unutrašnje sredine, a to su H+, CO2 i organska jedinjenja fosfora. Ovi regulatori imaju dubok uticaj na sposobnost hemoglobina da veže kiseonik, uprkos činjenici da se vezuju za protein u područjima udaljenim od hema. Općenito tzv alosterična interakcija, one. interakcije između prostorno odvojenih regiona javljaju se u mnogim proteinima. Alosterični efekti igraju bitnu ulogu u regulaciji i integraciji molekularnih procesa u biološkim sistemima. Hemoglobin je alosterični protein koji je najviše proučavan i stoga ima smisla detaljnije pogledati njegovu strukturu i funkciju.
KONFORMACIONE PROMENE HEMOGLOBINA
Vezivanje kiseonika je praćeno rupturom soli
veze koje formiraju terminalne karboksilne grupe
podjedinice (slika 7) Ovo olakšava vezivanje sledećih molekula
kisika, jer to zahtijeva rupturiranje manjeg broja
solne veze. Ove promjene značajno utiču
sekundarne, tercijarne i posebno kvartarne strukture
hemoglobin. U ovom slučaju se okreće jedan A/B par podjedinica
u odnosu na drugi A / B par, što dovodi do zbijanja
tetramer i povećanje afiniteta hema za kiseonik (sl. 8 i 9).
KONFORMACIONE PROMENE U OKRUŽENJU HEMOGRUPE
Oksigenacija hemoglobina je praćena strukturnim
promjene u okruženju hemogrupe. Kada je oksigeniran, atom
gvožđe, koje je u deoksihemoglobinu delovalo na 0,06 nm od
ravan hem prstena, povlači se u ovu ravan (sl.
10). Prateći atom gvožđa, on se približava hemu
proksimalni histidin (F8), kao i srodni susjedni
Molekul hemoglobina može biti u dva oblika - napetom i opuštenom. Opušteni oblik hemoglobina ima tendenciju da se zasiti kiseonikom 70 puta brže od napetog. Promjena frakcija napetog i opuštenog oblika u ukupnoj količini hemoglobina u krvi određuje S-oblik krivulje disocijacije oksihemoglobina, a samim tim i takozvani afinitet hemoglobina za kisik. Ako je vjerovatnoća prijelaza iz stresnog oblika hemoglobina u opušteni veća, tada se povećava afinitet hemoglobina za kisik i obrnuto. Vjerojatnost stvaranja ovih frakcija hemoglobina mijenja se naviše ili naniže pod utjecajem nekoliko faktora. Glavni faktor je vezivanje kiseonika za heminičku strukturu molekula hemoglobina. Štoviše, što više hemoglobina hemoglobina hemini vežu kisik u eritrocitima, to je lakši prijelaz molekula hemoglobina u relaksirani oblik i veći je njihov afinitet za kisik. Stoga je pri niskom PO2, koji se javlja u metabolički aktivnim tkivima, afinitet hemoglobina prema kisiku manji, a pri visokom PO2 veći. Čim hemoglobin uhvati kisik, njegov afinitet za kisik se povećava i molekula hemoglobina postaje zasićena kada se veže za četiri molekula kisika. Kada crvena krvna zrnca koja sadrže hemoglobin stignu do tkiva, kisik iz crvenih krvnih stanica difunduje u stanice. U mišićima ulazi u svojevrsni depo kisika - molekule mioglobina, iz kojih se kisik koristi u biološkoj oksidaciji mišića. Difuzija kiseonika iz hemoglobina eritrocita u tkiva je zbog niskog PO2 u tkivima - 35 mm Hg. Art. Unutar ćelija tkiva, napetost kisika potrebna za održavanje normalnog metabolizma je još niža - ne više od 1 kPa. Stoga kisik dolazi do metabolički aktivnih stanica difuzijom iz kapilara. Neka tkiva su prilagođena niskoj koncentraciji PO2 u krvnim kapilarama, što je nadoknađeno velikom gustinom kapilara po jedinici volumena tkiva. Na primjer, u skeletnim i srčanim mišićima, kapilarni PO2 može se izuzetno brzo smanjiti tokom kontrakcije. Mišićne ćelije sadrže protein koji se zove mioglobin, koji ima veći afinitet za kiseonik od hemoglobina. Mioglobin je intenzivno zasićen kisikom i potiče njegovu difuziju iz krvi u skeletne i srčane mišiće, gdje određuje procese biološke oksidacije. Ova tkiva su u stanju da izvuku do 70% kiseonika iz krvi koja prolazi kroz njih, što je posledica smanjenja afiniteta hemoglobina za kiseonik pod uticajem temperature tkiva i pH vrednosti. Utjecaj pH i temperature na afinitet hemoglobina prema kisiku. Molekule hemoglobina mogu reagirati s vodikovim ionima; kao rezultat ove reakcije, afinitet hemoglobina prema kisiku se smanjuje. Kada je zasićenost hemoglobinom manja od 100%, nizak pH smanjuje vezivanje kiseonika za hemoglobin - kriva disocijacije oksihemoglobina se pomera udesno duž x-ose. Ova promjena svojstva hemoglobina pod utjecajem vodikovih jona naziva se Bohrov efekat. Metabolički aktivna tkiva proizvode kiseline kao što su mliječna kiselina i CO2. Ako se pH krvne plazme smanji sa normalnih 7,4 na 7,2, što se događa kontrakcijom mišića, tada će se koncentracija kisika u njoj povećati zbog Bohrovog efekta. Na primjer, pri konstantnom pH od 7,4, krv bi davala oko 45% kisika, odnosno zasićenost hemoglobina kisikom se smanjila na 55%. Međutim, kada pH padne na 7,2, kriva disocijacije se pomera duž x-ose udesno. Kao rezultat toga, zasićenost hemoglobina kisikom pada na 40%, odnosno krv može dati do 60% kisika u tkivima, što je 1/3 više nego pri konstantnom pH. Metabolički aktivna tkiva povećavaju proizvodnju topline. Povećanje temperature tkiva tokom fizičkog rada mijenja omjer frakcija hemoglobina u eritrocitima i uzrokuje pomak krivulje disocijacije oksihemoglobina udesno duž x ose. Kao rezultat toga, više kisika će se osloboditi iz hemoglobina crvenih krvnih zrnaca i ući u tkiva. Utjecaj 2,3-difosfoglicerata (2,3-DPG) na afinitet hemoglobina prema kisiku. U nekim fiziološkim stanjima, na primjer, kada PO2 u krvi padne ispod normalnog (hipoksija) kao rezultat boravka osobe na velikoj nadmorskoj visini, opskrba tkiva kisikom postaje nedovoljna. Kod hipoksije, afinitet hemoglobina za kisik može se smanjiti zbog povećanja sadržaja 2,3-DPG u eritrocitima. Za razliku od Bohrovog efekta, smanjenje afiniteta hemoglobina za kisik pod utjecajem 2,3-DPG nije reverzibilno u kapilarama pluća. Međutim, kada se krv kreće kroz kapilare pluća, efekat 2,3-DPG na smanjenje stvaranja oksihemoglobina u eritrocitima (ravni dio krivulje disocijacije oksihemoglobina) je manje izražen od oslobađanja kisika ispod uticaj 2,3-DPG u tkivima (kosi deo krive), koji određuje normalno snabdevanje tkiva kiseonikom
Nativna trodimenzionalna struktura se uspostavlja kao rezultat djelovanja niza energetskih i entropijskih faktora. Promjena konformacijskog stanja proteinske molekule uslijed različitih vanjskih utjecaja (pH, temperatura, jonski sastav) odražava se na njegovu funkcionalnu aktivnost. Do konformacijskih preuređivanja dolazi vrlo brzo. U prvim fazama su lokalne mikrokonformacijske prirode, uzrokujući pomake samo pojedinačnih atomskih grupa. Proširenje takvih lokalnih pomaka na ostatak makromolekularne strukture dovest će do opće konformacijske promjene u molekuli biopolimera.
Mioglobin- sastoji se od jednog polipeptidnog lanca od 153 aminokiselinske ostatke i jedne grupe gvožđa porfirina (hem) po molekulu. Mioglobin se odnosi na hemoproteine koji mogu reverzibilno vezati kiseonik; u ćelijama skeletnih mišića odgovoran je za rezervisanje kiseonika, kao i za povećanje brzine njegove difuzije kroz ćelije. Filogenetski, mioglobin je prekursor hemoglobina. Molekul ne sadrži disulfidne veze i karakteriše ga 77% a-heličnosti. Hem, koji je odgovoran za vezivanje kiseonika, nalazi se u "hidrofobnom džepu" koji formiraju posebne aminokiseline namenjene za to. Hem je makrociklus protoporfirina sa koordinisanim dvovalentnim ionom gvožđa koji se nalazi u centru molekula. Ova prostorna fiksacija hema omogućava vezivanje molekule kiseonika kao šestog liganda.
Hemoglobin- "respiratorni" protein krvi. On prenosi kiseonik kroz cirkulatorni sistem pluća do drugih organa i centara potrošnje. Molekul hemoglobina se sastoji od četiri identična polipeptidna lanca u paru, od kojih svaki nosi hem. Polipeptidni lanci hemoglobina nazivaju se a i b , a simetrična struktura molekula je zapisana kao a 2 b 2 . Formiranje kvartarne strukture vrši se hidrofobnim interakcijama između pojedinačnih polipeptidnih lanaca. Kada se hemu doda kisik, nastaje oksihemoglobin, čija se kvartarna struktura samo malo razlikuje od neoksigeniranog oblika.
Dodatak kiseonika izaziva brojne konformacione promene u molekulu Hb. Vezivanje kiseonika sa prelaskom jona Fe 2+ u nisko-spinsko stanje je praćeno istovremenim pomeranjem gvožđa u ravan hem grupe. Dolazi do postepenog pucanja slanih mostova između a-podjedinica. Rastojanje između hema a - podjedinica se povećava, a između hema b podjedinica smanjuje. Općenito, oksigenacija prenosi svaku od podjedinica iz deoksi i oksikonformacije. Puknuće četiri od šest solnih mostova tokom oksigenacije prve dvije a-podjedinice olakšava rupturu druga dva mosta i stoga olakšava vezivanje sljedećih molekula kisika na preostale podjedinice, povećavajući njihov afinitet prema kisiku za nekoliko stotinu puta. Ovo je kooperativna priroda pristupanja.
5 (1). Primarne i sekundarne strukture DNK. Chargaffova pravila. Princip komplementarnosti. Vrste veza u molekulu DNK. Biološka uloga DNK. Molekularne bolesti su rezultat genskih mutacija.
Primarna struktura DNK - red izmjenjivanja deoksiribonukleozid monofosfata (dNMP) u polinukleotidnom lancu.
Svaka fosfatna grupa u polinukleotidnom lancu, sa izuzetkom ostatka fosfora na 5 "kraju molekule, učestvuje u formiranju dve etarske veze uz učešće 3" - i 5" atoma ugljenika dve susedne deoksiriboze, dakle veza između monomera je označena 3", 5" - fosfodiestar.
Terminalni nukleotidi DNK razlikuju se po svojoj strukturi: na kraju od 5" nalazi se fosfatna grupa, a na kraju 3" lanca nalazi se slobodna OH grupa. Ovi krajevi se nazivaju krajevi s 5 "- i 3". Linearna sekvenca deoksiribonukleotida u polimernom DNK lancu se obično skraćuje pomoću koda od jednog slova, na primjer -A-G-C-T-T-A-C-A- od 5 "do 3" -kraja.
Svaki monomer nukleinske kiseline sadrži ostatak fosforne kiseline. Dakle, pri pH 7 fosfatna grupa je potpuno jonizovana in vivo nukleinske kiseline postoje kao polianioni (imaju višestruki negativni naboj). Ostaci pentoze takođe pokazuju hidrofilna svojstva. Dušične baze su gotovo nerastvorljive u vodi, ali neki atomi purinskih i pirimidinskih prstenova mogu formirati vodonične veze.
Sekundarna struktura DNK. Godine 1953. J. Watson i F. Crick su predložili model prostorne strukture DNK. Prema ovom modelu, molekula DNK ima oblik spirale koju čine dva polinukleotidna lanca uvrnuta jedan u odnosu na drugi i oko zajedničke ose. Dvostruka spirala desnoruke, polinukleotidnog lanca u njemu antiparalelno(Slika 4-6), tj. ako je jedan od njih orijentisan u pravcu 3 "→ 5", onda drugi - u pravcu 5 "→ 3". Dakle, na svakom kraju
Rice. 4-6. Dvostruka spirala DNK. Molekuli DNK se sastoje od dva antiparalelna lanca s komplementarnom sekvencom nukleotida. Lanci su uvrnuti jedan u odnosu na drugi u desnoj spirali tako da ima oko 10 parova baza po okretu.
Molekuli DNK nalaze se na 5 "kraju jednog lanca i 3" kraju drugog lanca.
Sve baze lanaca DNK nalaze se unutar dvostruke spirale, a pentozofosfatna kičma je izvana. Polinukleotidni lanci se drže jedan u odnosu na drugi zahvaljujući vodoničnim vezama između komplementarnih purinskih i pirimidinskih azotnih baza A i T (dve veze) i između G i C (tri veze) (sl. 4-7). Uz ovu kombinaciju, svaki
Rice. 4-7. Parovi baza purin-pirimidin u DNK.
par sadrži tri prstena, tako da je ukupna veličina ovih parova baza ista duž cijele dužine molekula. Vodikove veze za druge kombinacije baza u paru su moguće, ali su mnogo slabije. Nukleotidna sekvenca jednog lanca potpuno je komplementarna nukleotidnoj sekvenci drugog lanca. Dakle, prema Chargaffovom pravilu (Erwin Chargaff je 1951. ustanovio obrasce u odnosu purinskih i pirimidinskih baza u molekuli DNK), broj purinskih baza (A + G) jednak je broju pirimidinskih baza (T + C) .
Komplementarne baze su naslagane u jezgru spirale. Između baza dvolančane molekule u hrpi, hidrofobne interakcije, stabilizirajuća dvostruka spirala.
Ova struktura isključuje kontakt azotnih ostataka sa vodom, ali snop baza ne može biti apsolutno okomit. Parovi baza su malo pomaknuti jedan od drugog. U formiranoj strukturi razlikuju se dva utora - veliki, širine 2,2 nm, i mali, širine 1,2 nm. Dušične baze u području glavnih i malih žljebova stupaju u interakciju sa specifičnim proteinima uključenim u organizaciju strukture kromatina.
Pravilo Chargaffa- sistem empirijski identifikovanih pravila koja opisuju kvantitativne odnose između različitih tipova azotnih baza u DNK. Formulirani su kao rezultat rada grupe biohemičara Erwina Chargaffa 1949-1951.
Prije rada Chargaffove grupe preovladavala je takozvana teorija "tetranukleotida" prema kojoj se DNK sastoji od ponavljajućih blokova četiri različite azotne baze (adenin, timin, guanin i citozin). Chargaff i njegovi saradnici uspjeli su odvojiti nukleotide DNK pomoću papirne hromatografije i odrediti tačne kvantitativne omjere različitih tipova nukleotida. One su se značajno razlikovale od ekvimolarnih, što bi se i očekivalo da su sve četiri baze prikazane u jednakim omjerima. Omjeri koje je Chargaff otkrio za adenin (A), timin (T), gvanin (G) i citozin (C) bili su sljedeći:
1. Količina adenina jednaka je količini timina, a količina gvanina jednaka količini citozina: A = T, G = C.
2. Količina purina jednaka je količini pirimidina: A + G = T + C.
3. Broj baza sa amino grupama na poziciji 6 jednak je broju baza sa keto grupama na poziciji 6: A + C = G + T.
Istovremeno, omjer (A + T) :( G + C) može biti različit za različite tipove DNK. Nekima dominiraju AT parovi, dok drugima dominiraju GC.
Chargaffova pravila, zajedno sa podacima rendgenske strukturne analize, odigrala su odlučujuću ulogu u dešifriranju strukture DNK od strane J. Watsona i Francisa Cricka.
Komplementarnost(v hemija, molekularne biologije i genetika) - međusobna korespondencija molekula biopolimeri ili njihovih fragmenata, osiguravajući stvaranje veza između prostorno komplementarnih (komplementarnih) fragmenata molekula ili njihovih strukturnih fragmenata zbog supramolekularne interakcije(formiranje vodoničnih veza, hidrofobne interakcije, elektrostatičke interakcije nabijenih funkcionalnih grupa, itd.).
Interakcija komplementarnih fragmenata ili biopolimera nije praćena stvaranjem kovalentnog hemijska veza između komplementarnih fragmenata, međutim, zbog prostorne međusobne korespondencije komplementarnih fragmenata, to dovodi do stvaranja mnogih relativno slabih veza (vodikova i van der Waalsovih) sa dovoljno visokom ukupnom energijom, što dovodi do stvaranja stabilnih molekularnih kompleksa.
Istovremeno, treba napomenuti da je mehanizam katalitičke aktivnosti enzima određen komplementarnošću enzima i prijelaznog stanja ili međuproizvoda katalizirane reakcije - au ovom slučaju reverzibilno stvaranje kemijske tvari. može doći do veze.
Komplementarnost nukleinske kiseline
Kada nukleinske kiseline- i oligo- i polinukleotidne azotne baze nukleotidi sposoban zbog obrazovanja vodonične veze formiraju uparene komplekse adenin-timina(ili uracil v RNA) i gvanin-citozin u interakciji lanaca nukleinske kiseline... Ova interakcija igra ključnu ulogu u brojnim fundamentalnim procesima skladištenja i prijenosa genetskih informacija: DNK replikacija osiguravanje prijenosa genetskih informacija tokom diobe ćelije, transkripcije DNK u RNK tokom sinteze proteini DNK kodiran gen, skladištenje genetskih informacija u dvolančanoj DNK i procesima popravke DNK kada je oštećena.
U sintezi DNK koristi se princip komplementarnosti. Ovo je striktno poštivanje spoja azotnih baza, povezanih vodoničnim vezama, u kojima: AT ( Adenin povezuje sa Timin) G-C ( Guanine povezuje sa Citozin)
Enzimska kataliza
Komplementarno vezivanje enzim-supstrat je ključni faktor u mehanizmu enzimske aktivnosti i, za razliku od gore opisanih situacija sa formiranjem hemijski nevezanih kompleksa, može dovesti do pokretanja hemijske reakcije – u slučaju veze. enzim sa supstratom, komplementarnost je relativno niska, međutim, uz visoku komplementarnost sa prelaznim reakcionim stanjem supstrata, ovo stanje se stabilizuje, što dovodi do efekta katalitičke aktivnosti enzima: takva stabilizacija prelaznog stanja je ekvivalentna do smanjenja aktivaciona energija i, shodno tome, naglo povećanje brzine reakcije.
Struktura modula | Teme |
Modularna jedinica 1 | 1.1. Strukturna organizacija proteina. Faze formiranja konformacije nativnog proteina 1.2. Osnove funkcionisanja proteina. Lijekovi kao ligandi koji utječu na funkciju proteina 1.3. Denaturacija proteina i mogućnost njihovog spontanog obnavljanja |
Modularna jedinica 2 | 1.4. Osobine strukture i funkcioniranja oligomernih proteina na primjeru hemoglobina 1.5. Održavanje prirodne konformacije proteina u ćelijskim uslovima 1.6. Raznolikost proteina. Porodice proteina kao primjer imunoglobulina 1.7. Fizičko-hemijska svojstva proteina i metode njihovog odvajanja |
Modularna jedinica 1 STRUKTURNA ORGANIZACIJA MONOMERNIH PROTEINA I OSNOV NJIHOVOG FUNKCIONISANJA
Ciljevi učenja Biti u stanju:
1. Iskoristiti znanje o karakteristikama strukture proteina i ovisnosti funkcija proteina o njihovoj strukturi za razumijevanje mehanizama razvoja nasljednih i stečenih proteinopatija.
2. Objasniti mehanizme terapijskog djelovanja nekih lijekova kao liganada koji stupaju u interakciju s proteinima i mijenjaju njihovu aktivnost.
3. Koristite znanje o strukturi i konformacionoj labilnosti proteina da biste razumeli njihovu strukturnu i funkcionalnu nestabilnost i sklonost denaturaciji u promenljivim uslovima.
4. Objasniti upotrebu denaturirajućih sredstava kao sredstava za sterilizaciju medicinskog materijala i instrumenata, kao i antiseptika.
znati:
1. Nivoi strukturne organizacije proteina.
2. Vrijednost primarne strukture proteina, koja određuje njihovu strukturnu i funkcionalnu raznolikost.
3. Mehanizam formiranja aktivnog centra u proteinima i njegova specifična interakcija sa ligandom koji je u osnovi funkcionisanja proteina.
4. Primjeri utjecaja egzogenih liganada (lijekova, toksina, otrova) na konformaciju i funkcionalnu aktivnost proteina.
5. Uzroci i posljedice denaturacije proteina, faktori koji uzrokuju denaturaciju.
6. Primjeri upotrebe denaturirajućih faktora u medicini kao antiseptika i sredstava za sterilizaciju medicinskih instrumenata.
TEMA 1.1. STRUKTURNA ORGANIZACIJA PROTEINA. FAZE FORMIRANJA DOMAĆEG
PROTEINSKA KONFORMACIJA
Proteini su polimerni molekuli sa samo 20 α-amino kiselina kao monomera. Skup i red kojim se aminokiseline kombinuju u protein određen je strukturom gena u DNK pojedinca. Svaki protein, u skladu sa svojom specifičnom strukturom, obavlja svoju funkciju. Skup proteina određenog organizma određuje njegove fenotipske karakteristike, kao i prisustvo nasljednih bolesti ili predispoziciju za njihov razvoj.
1. Aminokiseline koje čine proteine. Peptidna veza. Proteini su polimeri izgrađeni od monomera - 20 α-amino kiselina, čija je opšta formula
Aminokiseline se razlikuju po strukturi, veličini, fizičko-hemijskim svojstvima radikala vezanih za α-ugljikov atom. Funkcionalne grupe aminokiselina određuju karakteristike svojstava različitih α-amino kiselina. Radikali koji se nalaze u α-amino kiselinama mogu se podijeliti u nekoliko grupa:
prolin, za razliku od ostalih 19 proteinskih monomera, to nije amino kiselina, već iminokiselina, radikal u prolinu je vezan i za α-ugljikov atom i za imino grupu
 Aminokiseline se razlikuju po svojoj rastvorljivosti u vodi. To je zbog sposobnosti radikala da komuniciraju s vodom (hidratom).
Aminokiseline se razlikuju po svojoj rastvorljivosti u vodi. To je zbog sposobnosti radikala da komuniciraju s vodom (hidratom).
TO hidrofilna uključuje radikale koji sadrže anionske, kationske i polarne nenabijene funkcionalne grupe.
TO hidrofobna uključuje radikale koji sadrže metilne grupe, alifatske lance ili cikluse.
2. Peptidne veze povezuju aminokiseline u peptide. U sintezi peptida, α-karboksilna grupa jedne aminokiseline stupa u interakciju sa α-amino grupom druge amino kiseline i formira peptidna veza:
Proteini su polipeptidi, tj. linearni polimeri α-amino kiselina povezanih peptidnom vezom (slika 1.1.)
 Rice. 1.1. Termini koji se koriste za opisivanje strukture peptida
Rice. 1.1. Termini koji se koriste za opisivanje strukture peptida
Monomeri aminokiselina koji čine polipeptide nazivaju se aminokiselinskih ostataka. Lanac ponavljajućih grupa - NH-CH-CO- forme peptidna kičma. Aminokiselinski ostatak koji ima slobodnu α-amino grupu naziva se N-terminal, a onaj koji ima slobodnu α-karboksilnu grupu naziva se C-terminal. Peptidi se zapisuju i čitaju od N-kraja do C-kraja.
Peptidna veza koju formira imino grupa prolina razlikuje se od ostalih peptidnih veza: atomu azota peptidne grupe nedostaje vodonik,
umjesto toga, postoji veza s radikalom, kao rezultat, jedna strana ciklusa je uključena u peptidnu kičmu:
 Peptidi se razlikuju po sastavu aminokiselina, broju aminokiselina i redoslijedu u kojem su aminokiseline kombinovane, na primjer, Ser-Ala-Glu-Gis i Gis-Glu-Ala-Ser su dva različita peptida.
Peptidi se razlikuju po sastavu aminokiselina, broju aminokiselina i redoslijedu u kojem su aminokiseline kombinovane, na primjer, Ser-Ala-Glu-Gis i Gis-Glu-Ala-Ser su dva različita peptida.
Peptidne veze su veoma jake, a njihova hemijska neenzimska hidroliza zahteva stroge uslove: analizirani protein se hidrolizira u koncentrovanoj hlorovodoničnoj kiselini na temperaturi od oko 110° tokom 24 sata. U živoj ćeliji, peptidne veze se mogu razbiti pomoću proteolitički enzimi, pozvao proteaze ili peptidne hidrolaze.
3. Primarna struktura proteina. Aminokiselinski ostaci u peptidnim lancima različitih proteina ne izmjenjuju se nasumično, već su raspoređeni određenim redoslijedom. Linearni niz ili red alternacije aminokiselinskih ostataka u polipeptidnom lancu naziva se primarna struktura proteina.
Primarna struktura svakog pojedinačnog proteina je kodirana u molekulu DNK (u regionu koji se zove genom) i ostvaruje se tokom transkripcije (prepisivanje informacija o mRNA) i translacije (sinteza primarne strukture proteina). Shodno tome, primarna struktura proteina pojedinca je informacija koja se nasledno prenosi sa roditelja na decu, a koja određuje strukturne karakteristike proteina datog organizma, od kojih zavisi funkcija dostupnih proteina (slika 1.2.).
 Rice. 1.2. Odnos između genotipa i konformacije proteina sintetiziranih u tijelu pojedinca
Rice. 1.2. Odnos između genotipa i konformacije proteina sintetiziranih u tijelu pojedinca
Svaki od otprilike 100.000 pojedinačnih proteina u ljudskom tijelu ima jedinstven primarna struktura. Molekuli jedne vrste proteina (na primjer, albumin) imaju istu izmjenu aminokiselinskih ostataka, što albumin razlikuje od bilo kojeg drugog pojedinačnog proteina.
Niz aminokiselinskih ostataka u peptidnom lancu može se smatrati oblikom snimanja informacija. Ova informacija određuje prostorno savijanje linearnog peptidnog lanca u kompaktniju trodimenzionalnu strukturu tzv. konformacija vjeverica. Proces formiranja funkcionalno aktivne proteinske konformacije naziva se preklapanje.
4. Konformacija proteina. Slobodna rotacija u peptidnoj kičmi je moguća između atoma dušika peptidne grupe i susjednog α-ugljičnog atoma, kao i između α-ugljičnog atoma i ugljika karbonilne grupe. Zbog interakcije funkcionalnih grupa aminokiselinskih ostataka, primarna struktura proteina može dobiti složenije prostorne strukture. U globularnim proteinima postoje dva glavna nivoa savijanja konformacije peptidnih lanaca: sekundarno i tercijarne strukture.
Sekundarna struktura proteina je prostorna struktura nastala kao rezultat formiranja vodoničnih veza između funkcionalnih grupa -C = O i -NH- peptidne kičme. U ovom slučaju, peptidni lanac može dobiti pravilne strukture dva tipa: α-helix i β-strukture.
V α-helix formiraju se vodikove veze između atoma kisika karbonilne grupe i vodika amidnog dušika 4. aminokiseline iz nje; bočni lanci aminokiselinskih ostataka
nalaze se duž periferije spirale, bez učešća u formiranju sekundarne strukture (slika 1.3.).
Krupni radikali ili radikali koji nose iste naboje sprečavaju stvaranje α-heliksa. Ostatak prolina, koji ima prstenastu strukturu, prekida α-heliks, jer je zbog odsustva vodonika na atomu dušika u peptidnom lancu nemoguće formirati vodikovu vezu. Veza između azota i atoma α-ugljika je dio prolinskog ciklusa; stoga, peptidna kičma u ovom trenutku postaje savijena.
β-struktura formira se između linearnih regiona peptidne kičme jednog polipeptidnog lanca, formirajući tako presavijene strukture. Mogu se formirati polipeptidni lanci ili njihovi dijelovi paralelno ili antiparalelne β-strukture. U prvom slučaju, N- i C-kraj peptidnih lanaca u interakciji se poklapaju, au drugom imaju suprotan smjer (slika 1.4).
Rice. 1.3. Sekundarna struktura proteina - α-helix
 Rice. 1.4. Paralelne i antiparalelne β-presavijene strukture
Rice. 1.4. Paralelne i antiparalelne β-presavijene strukture
β-strukture su označene širokim strelicama: A - Antiparalelna β-struktura. B - Paralelne β-presavijene strukture
U nekim proteinima, β-strukture se mogu formirati zbog formiranja vodoničnih veza između atoma peptidne kičme različitih polipeptidnih lanaca.
Takođe se nalazi u proteinima područja sa nepravilnim sekundarnim strukture, koje uključuju krivine, petlje, zavoje polipeptidne kičme. Često se nalaze na mjestima gdje se mijenja smjer peptidnog lanca, na primjer, tokom formiranja paralelne strukture β-listova.
Prema prisustvu α-heliksa i β-struktura, globularni proteini se mogu podijeliti u četiri kategorije.
Rice. 1.5. Sekundarna struktura mioglobina (A) i β-lanaca hemoglobina (B), koja sadrži osam α-heliksa

 Rice. 1.6. Sekundarna struktura domena trioza fosfat izomeraze i piruvat kinaze
Rice. 1.6. Sekundarna struktura domena trioza fosfat izomeraze i piruvat kinaze
 Rice. 1.7. Sekundarna struktura konstantne domene imunoglobulina (A) i enzima superoksid dismutaze (B)
Rice. 1.7. Sekundarna struktura konstantne domene imunoglobulina (A) i enzima superoksid dismutaze (B)
V četvrta kategorija uključeni proteini koji sadrže malu količinu regularnih sekundarnih struktura. To uključuje male proteine ili metaloproteine bogate cisteinom.
Tercijarna struktura proteina- vrsta konformacije nastala zbog interakcije između radikala aminokiselina, koji se mogu nalaziti na znatnoj udaljenosti jedan od drugog u peptidnom lancu. U ovom slučaju većina proteina formira prostornu strukturu koja liči na globulu (globularni proteini).
Budući da hidrofobni radikali aminokiselina imaju tendenciju spajanja pomoću tzv hidrofobne interakcije i intermolekularnih van der Waalsovih sila, unutar proteinske globule formira se gusto hidrofobno jezgro. Hidrofilni jonizovani i nejonizovani radikali uglavnom se nalaze na površini proteina i određuju njegovu rastvorljivost u vodi.
 Rice. 1.8. Vrste veza koje nastaju između radikala aminokiselina tokom formiranja tercijarne strukture proteina
Rice. 1.8. Vrste veza koje nastaju između radikala aminokiselina tokom formiranja tercijarne strukture proteina
1 - jonska veza- javlja se između pozitivno i negativno nabijenih funkcionalnih grupa;
2 - vodonična veza- javlja se između nenabijene hidrofilne grupe i bilo koje druge hidrofilne grupe;
3 - hidrofobne interakcije- nastaju između hidrofobnih radikala;
4 - disulfidna veza- nastaju zbog oksidacije SH-grupa cisteinskih ostataka i njihove međusobne interakcije
Hidrofilni aminokiselinski ostaci zarobljeni unutar hidrofobnog jezgra mogu međusobno komunicirati koristeći jonski i vodonične veze(sl. 1.8).
Jonske i vodonične veze, kao i hidrofobne interakcije, spadaju među slabe: njihova energija nije mnogo veća od energije toplinskog kretanja molekula na sobnoj temperaturi. Konformacija proteina se održava kroz pojavu mnogih od ovih slabih veza. Budući da su atomi koji čine protein u stalnom kretanju, neke slabe veze se mogu prekinuti, a druge formirati, što dovodi do malih pomaka pojedinih dijelova polipeptidnog lanca. Ovo svojstvo proteina da mijenjaju konformaciju kao rezultat kidanja nekih i stvaranja drugih slabih veza naziva se konformaciona labilnost.
Ljudsko tijelo ima sisteme koji podržavaju homeostaza- postojanost unutrašnje sredine u određenim granicama dozvoljenim za zdrav organizam. U uslovima homeostaze, male promjene u konformaciji ne remete ukupnu strukturu i funkciju proteina. Funkcionalno aktivna konformacija proteina se naziva nativnom konformacijom. Promjena unutrašnje sredine (na primjer, koncentracija glukoze, Ca jona, protona itd.) dovodi do promjene konformacije i disfunkcije proteina.
Tercijarna struktura nekih proteina je stabilizirana disulfidne veze, nastala zbog interakcije -SH grupa dva ostatka
 Rice. 1.9. Formiranje disulfidne veze u molekulu proteina
Rice. 1.9. Formiranje disulfidne veze u molekulu proteina
cistein (slika 1.9). Većina intracelularnih proteina nema kovalentne disulfidne veze u tercijarnoj strukturi. Njihovo prisustvo je karakteristično za proteine koje luči ćelija, što im obezbeđuje veću stabilnost u vanćelijskim uslovima. Dakle, disulfidne veze se nalaze u molekulima inzulina i imunoglobulina.
Insulin- proteinski hormon koji se sintetizira u β-ćelijama pankreasa i izlučuje u krv kao odgovor na povećanje koncentracije glukoze u krvi. U strukturi insulina postoje dve disulfidne veze koje povezuju polipeptidne A- i B-lance, i jedna disulfidna veza unutar A-lanca (slika 1.10).
 Rice. 1.10. Disulfidne veze u strukturi inzulina
Rice. 1.10. Disulfidne veze u strukturi inzulina
5. Supersekundarna struktura proteina. U proteinima koji se razlikuju po svojoj primarnoj strukturi i funkcijama, slične kombinacije i raspored sekundarnih struktura, koje se nazivaju supersekundarna struktura. Zauzima srednju poziciju između sekundarne i tercijarne strukture, budući da se radi o specifičnoj kombinaciji elemenata sekundarne strukture u formiranju tercijarne strukture proteina. Supersekundarne strukture imaju specifične nazive kao što su “α-helix-turn-a-helix”, “leucinski zatvarač”, “cinkovi prsti” itd. Takve supersekundarne strukture su karakteristične za proteine koji se vezuju za DNK.
Leucine patent zatvarač. Ova vrsta supersekundarne strukture se koristi za povezivanje dva proteina. Na površini proteina u interakciji postoje α-helikalni regioni koji sadrže najmanje četiri leucinska ostatka. Leucinski ostaci u α-heliksu nalaze se šest aminokiselina međusobno udaljeni. Budući da svaki zavoj α-heliksa sadrži 3,6 aminokiselinskih ostataka, leucinski radikali se nalaze na površini svakog drugog zavoja. Leucinski ostaci α-heliksa jednog proteina mogu stupiti u interakciju sa ostacima leucina drugog proteina (hidrofobne interakcije), povezujući ih zajedno (slika 1.11.). Mnogi proteini koji se vezuju za DNK funkcionišu kao dio oligomernih kompleksa, gdje se pojedinačne podjedinice vezuju jedna za drugu pomoću "leucinskih spojnica".
 Rice. 1.11. "Leucinski zatvarač" između α-helikalnih regiona dva proteina
Rice. 1.11. "Leucinski zatvarač" između α-helikalnih regiona dva proteina
Primjer takvih proteina su histoni. Histoni- nuklearni proteini, koji uključuju veliki broj pozitivno nabijenih aminokiselina - arginin i lizin (do 80%). Molekuli histona se kombinuju u oligomerne komplekse koji sadrže osam monomera pomoću "leucinskih spojnica", uprkos značajnom naboju istog imena ovih molekula.
"cink prst"- varijanta supersekundarne strukture, karakteristična za proteine koji se vezuju za DNK, ima oblik izduženog fragmenta na površini proteina i sadrži oko 20 aminokiselinskih ostataka (slika 1.12). Oblik "izduženog prsta" podržava atom cinka koji je povezan s radikalima četiri aminokiseline - dva cisteinska i dva histidinska ostatka. U nekim slučajevima, umjesto ostataka histidina, postoje ostaci cisteina. Dva usko raspoređena cisteinska ostatka odvojena su od druga dva Gisili ostatka nizom od oko 12 aminokiselinskih ostataka. Ovaj region proteina formira α-heliks, čiji se radikali mogu specifično vezati za regulatorne regione glavnog žleba DNK. Obavezujuća specifičnost pojedinca
 Rice. 1.12. Primarna struktura regije proteina koji vežu DNK koji formiraju strukturu "cinkovog prsta" (slova označavaju aminokiseline koje čine ovu strukturu)
Rice. 1.12. Primarna struktura regije proteina koji vežu DNK koji formiraju strukturu "cinkovog prsta" (slova označavaju aminokiseline koje čine ovu strukturu)
Regulatorni protein koji vezuje DNK zavisi od redosleda aminokiselinskih ostataka koji se nalaze u "cinkovom prstu". Takve strukture sadrže, posebno, receptore za steroidne hormone uključene u regulaciju transkripcije (čitanje informacija od DNK do RNK).
TEMA 1.2. OSNOVE FUNKCIONISANJA PROTEINA. LIJEKOVI KAO LIGADI KOJI UTIČU NA FUNKCIJU PROTEINA
1. Aktivni centar proteina i njegova interakcija sa ligandom. Prilikom formiranja tercijarne strukture na površini funkcionalno aktivnog proteina, obično u depresiji, formira se regija koju formiraju radikali aminokiselina koji su u primarnoj strukturi udaljeni jedan od drugog. Ovo mjesto, koje ima jedinstvenu strukturu za dati protein i koje je sposobno za specifičnu interakciju s određenim molekulom ili grupom sličnih molekula, naziva se mjesto vezivanja protein-ligand ili aktivno mjesto. Ligandi su molekuli koji stupaju u interakciju s proteinima.
Visoka specifičnost interakcija proteina sa ligandom je obezbeđena komplementarnošću strukture aktivnog centra sa strukturom liganda.
Komplementarnost je prostorna i hemijska korespondencija površina u interakciji. Aktivni centar ne samo da prostorno odgovara ligandu koji je u njemu uključen, već i veze (ionske, vodikove i hidrofobne interakcije) treba da se formiraju između funkcionalnih grupa radikala uključenih u aktivni centar i liganda koji drži ligand. u aktivnom centru (slika 1.13).
 Rice. 1.13. Komplementarna interakcija proteina sa ligandom
Rice. 1.13. Komplementarna interakcija proteina sa ligandom
Neki ligandi, vezujući se za aktivni centar proteina, igraju pomoćnu ulogu u funkcionisanju proteina. Takvi ligandi se nazivaju kofaktori, a proteini koji sadrže neproteinski dio nazivaju se kompleksnih proteina(za razliku od jednostavnih proteina, koji se sastoje samo od proteinskog dijela). Neproteinski dio, čvrsto vezan za protein, naziva se protetska grupa. Na primjer, sastav mioglobina, hemoglobina i citokroma sadrži prostetičku grupu koja je čvrsto vezana za aktivni centar - hem, koji sadrži ion željeza. Složeni proteini koji sadrže hem nazivaju se hemoproteini.
Kada su specifični ligandi vezani za proteine, očituje se funkcija ovih proteina. Dakle, albumin, najvažniji protein u krvnoj plazmi, svoju transportnu funkciju ispoljava vezivanjem hidrofobnih liganda za aktivni centar, kao što su masne kiseline, bilirubin, neki lijekovi itd. (Slika 1.14)
Ligandi koji stupaju u interakciju s trodimenzionalnom strukturom peptidnog lanca mogu biti ne samo organske i neorganske molekule male molekularne težine, već i makromolekule:
DNK (gornji primjeri sa DNK-vezujućim proteinima);
Polisaharidi;
 Rice. 1.14. Odnos genotipa i fenotipa
Rice. 1.14. Odnos genotipa i fenotipa
Jedinstvena primarna struktura ljudskih proteina, kodirana u molekuli DNK, ostvaruje se u ćelijama u obliku jedinstvene konformacije, strukture aktivnog centra i funkcija proteina.
U ovim slučajevima, protein prepoznaje specifično mjesto liganda srazmjerno i komplementarno mjestu vezivanja. Dakle, na površini hepatocita postoje proteini receptori za hormon insulin, koji takođe ima proteinsku strukturu. Interakcija insulina sa receptorom uzrokuje promjenu njegove konformacije i aktivaciju signalnih sistema, što dovodi do akumulacije nutrijenata u hepatocitima nakon jela.
Na ovaj način, funkcionisanje proteina se zasniva na specifičnoj interakciji aktivnog centra proteina sa ligandom.
2. Struktura domena i njena uloga u funkcionisanju proteina. Dugi polipeptidni lanci globularnih proteina često se savijaju u nekoliko kompaktnih, relativno nezavisnih regija. Imaju nezavisnu tercijarnu strukturu, sličnu onoj kod globularnih proteina, i nazivaju se domene. Zbog domenske strukture proteina, njihova tercijarna struktura se lakše formira.
U domenskim proteinima, mjesta vezivanja liganda se često nalaze između domena. Dakle, tripsin je proteolitički enzim koji proizvodi egzokrini dio pankreasa i neophodan je za probavu proteina hrane. Ima strukturu sa dve domene, a mesto vezivanja za tripsin sa njegovim ligandom, proteinom hrane, nalazi se u žlebu između dve domene. U aktivnom centru stvaraju se uslovi koji su neophodni za efikasno vezivanje određenog mesta proteina hrane i hidrolizu njegovih peptidnih veza.
Kada aktivni centar stupi u interakciju sa ligandom, različiti domeni u proteinu mogu se kretati jedan u odnosu na drugi (slika 1.15).
Heksokinaza- enzim koji katalizuje fosforilaciju glukoze pomoću ATP-a. Aktivno mjesto enzima nalazi se u rascjepu između dva domena. Kada se heksokinaza veže za glukozu, okolni domeni se zatvaraju i supstrat je zarobljen, gdje dolazi do fosforilacije (vidi sliku 1.15).
 Rice. 1.15. Vezivanje domena heksokinaze za glukozu
Rice. 1.15. Vezivanje domena heksokinaze za glukozu
U nekim proteinima, domeni obavljaju nezavisne funkcije vezujući se za različite ligande. Ovi proteini se nazivaju multifunkcionalnim.
3. Lijekovi - ligandi koji utiču na funkciju proteina. Interakcija proteina sa ligandima je specifična. Međutim, zbog konformacijske labilnosti proteina i njegovog aktivnog centra, moguće je odabrati drugu supstancu koja bi također mogla stupiti u interakciju s proteinom u aktivnom centru ili drugom dijelu molekule.
Tvar slična strukturom prirodnom ligandu naziva se strukturni analog liganda ili neprirodni ligand. Također stupa u interakciju s proteinom na aktivnom mjestu. Strukturni analog liganda može poboljšati funkciju proteina (agonist), pa smanji (antagonista). Ligand i njegovi strukturni analozi se međusobno takmiče za vezivanje za protein u istom centru. Takve supstance se nazivaju kompetitivni modulatori(regulatori) proteinskih funkcija. Mnogi lijekovi djeluju kao inhibitori proteina. Neki od njih se dobijaju hemijskom modifikacijom prirodnih liganada. Inhibitori proteina mogu biti lijekovi i otrovi.
Atropin je kompetitivni inhibitor M-holinergičkih receptora. Acetilholin je neurotransmiter za prijenos nervnih impulsa kroz holinergičke sinapse. Da bi sproveo ekscitaciju, acetilholin koji se oslobađa u sinaptičku pukotinu mora stupiti u interakciju s proteinom - receptorom postsinaptičke membrane. Pronađene dvije vrste holinergički receptori:
M-receptor, pored acetilkolina, selektivno stupa u interakciju s muskarinom (toksinom mušice). M - holinergički receptori prisutni su na glatkim mišićima i, u interakciji s acetilkolinom, uzrokuju njihovu kontrakciju;
H-receptor, specifično vezujući za nikotin. H-holinergički receptori se nalaze u sinapsama prugasto-prugastih skeletnih mišića.
Specifični inhibitor M-holinergički receptori je atropin. Nalazi se u biljkama beladone i kokošije.
 Atropin po strukturi ima funkcionalne grupe slične acetilkolinu i njihov prostorni raspored, stoga spada u kompetitivne inhibitore M-holinergičkih receptora. S obzirom da vezivanje acetilholina za M-holinergičke receptore izaziva kontrakciju glatkih mišića, atropin se koristi kao lijek koji ublažava grčeve mišića. (antispazmodik). Dakle, poznato je da upotreba atropina opušta očne mišiće pri gledanju fundusa, kao i da ublažava grčeve kod gastrointestinalnih kolika. M-holinergički receptori su prisutni i u centralnom nervnom sistemu (CNS), pa velike doze atropina mogu izazvati neželjenu reakciju centralnog nervnog sistema: motoričku i mentalnu agitaciju, halucinacije, konvulzije.
Atropin po strukturi ima funkcionalne grupe slične acetilkolinu i njihov prostorni raspored, stoga spada u kompetitivne inhibitore M-holinergičkih receptora. S obzirom da vezivanje acetilholina za M-holinergičke receptore izaziva kontrakciju glatkih mišića, atropin se koristi kao lijek koji ublažava grčeve mišića. (antispazmodik). Dakle, poznato je da upotreba atropina opušta očne mišiće pri gledanju fundusa, kao i da ublažava grčeve kod gastrointestinalnih kolika. M-holinergički receptori su prisutni i u centralnom nervnom sistemu (CNS), pa velike doze atropina mogu izazvati neželjenu reakciju centralnog nervnog sistema: motoričku i mentalnu agitaciju, halucinacije, konvulzije.
Ditilin je kompetitivni agonist H-holinergičkih receptora koji inhibira funkciju neuromuskularnih sinapsi.
 Neuromuskularne sinapse skeletnih mišića sadrže H-holinergičke receptore. Njihova interakcija s acetilkolinom dovodi do mišićnih kontrakcija. Kod nekih operativnih zahvata, kao i endoskopskih pregleda, koriste se lijekovi koji uzrokuju opuštanje skeletnih mišića (mišićni relaksanti). To uključuje ditilin, koji je strukturni analog acetilholina. Veže se za H-holinergičke receptore, ali za razliku od acetilholina, vrlo sporo ga uništava enzim acetilholinesteraza. Kao rezultat dugotrajnog otvaranja jonskih kanala i uporne depolarizacije membrane, poremećena je provodljivost nervnog impulsa i dolazi do opuštanja mišića. U početku su ova svojstva pronađena u otrovu kurare, pa se takvi lijekovi nazivaju curariform.
Neuromuskularne sinapse skeletnih mišića sadrže H-holinergičke receptore. Njihova interakcija s acetilkolinom dovodi do mišićnih kontrakcija. Kod nekih operativnih zahvata, kao i endoskopskih pregleda, koriste se lijekovi koji uzrokuju opuštanje skeletnih mišića (mišićni relaksanti). To uključuje ditilin, koji je strukturni analog acetilholina. Veže se za H-holinergičke receptore, ali za razliku od acetilholina, vrlo sporo ga uništava enzim acetilholinesteraza. Kao rezultat dugotrajnog otvaranja jonskih kanala i uporne depolarizacije membrane, poremećena je provodljivost nervnog impulsa i dolazi do opuštanja mišića. U početku su ova svojstva pronađena u otrovu kurare, pa se takvi lijekovi nazivaju curariform.
TEMA 1.3. DENATURACIJA PROTEINA I MOGUĆNOST NJIHOVE SPONTANE RENATIVACIJE
1. Budući da se nativna konformacija proteina održava zbog slabih interakcija, promjene u sastavu i svojstvima okoline koja okružuje protein, izlaganje hemijskim reagensima i fizičkim faktorima uzrokuju promjenu njihove konformacije (svojstvo konformacijske labilnosti). Prekid velikog broja veza dovodi do razaranja nativne konformacije i denaturacije proteina.
Denaturacija proteina- to je uništenje njihove nativne konformacije pod djelovanjem denaturirajućih agenasa, uzrokovano pucanjem slabih veza koje stabiliziraju prostornu strukturu proteina. Denaturacija je praćena uništavanjem jedinstvene trodimenzionalne strukture i aktivnog centra proteina i gubitkom njegove biološke aktivnosti (slika 1.16).
Svi denaturirani molekuli jednog proteina dobijaju nasumičnu konformaciju koja se razlikuje od ostalih molekula istog proteina. Radikali aminokiselina koji formiraju aktivni centar prostorno su udaljeni jedan od drugog, tj. specifično vezno mjesto proteina sa ligandom je uništeno. Tokom denaturacije, primarna struktura proteina ostaje nepromijenjena.
Upotreba denaturirajućih sredstava u biološkim istraživanjima i medicini. U biohemijskim studijama, prije određivanja jedinjenja niske molekularne težine u biološkom materijalu, proteini se obično prvo uklanjaju iz otopine. U tu svrhu najčešće se koristi trihloroctena kiselina (TCA). Nakon dodavanja TCA u otopinu, denaturirani proteini se talože i lako se uklanjaju filtracijom (Tabela 1.1.)
U medicini se denaturirajuća sredstva često koriste za sterilizaciju medicinskih instrumenata i materijala u autoklavima (sredstvo za denaturiranje - visoka temperatura) i kao antiseptici (alkohol, fenol, hloramin) za tretiranje kontaminiranih površina koje sadrže patogenu mikrofloru.
2. Spontana obnova proteina- dokaz determinizma primarne strukture, konformacije i funkcije proteina. Pojedinačni proteini su proizvodi jednog gena koji imaju identičnu sekvencu aminokiselina i stiču istu konformaciju u ćeliji. Osnovni zaključak da primarna struktura proteina već sadrži informacije o njegovoj konformaciji i funkciji donesen je na osnovu sposobnosti nekih proteina (posebno ribonukleaze i mioglobina) da se spontano regeneriraju – da nakon denaturacije obnove svoju nativnu konformaciju.
Formiranje prostornih struktura proteina vrši se metodom samosastavljanja - spontanog procesa u kojem polipeptidni lanac, koji ima jedinstvenu primarnu strukturu, teži da usvoji konformaciju sa najnižom slobodnom energijom u rastvoru. Sposobnost obnavljanja proteina koji zadržavaju svoju primarnu strukturu nakon denaturacije opisana je u eksperimentu sa enzimom ribonukleazom.
Ribonukleaza je enzim koji razbija veze između pojedinačnih nukleotida u molekuli RNK. Ovaj globularni protein ima jedan polipeptidni lanac, čija je tercijarna struktura stabilizirana mnogim slabim i četiri disulfidne veze.
Tretman ribonukleaze ureom, koja uništava vodikove veze u molekuli, i redukcionim agensom koji razbija disulfidne veze, dovodi do denaturacije enzima i gubitka njegove aktivnosti.
Uklanjanje denaturirajućih agenasa dijalizom rezultira obnavljanjem konformacije i funkcije proteina, tj. do obnove. (sl. 1.17).
 Rice. 1.17. Denaturacija i renesansa ribonukleaze
Rice. 1.17. Denaturacija i renesansa ribonukleaze
A - nativna konformacija ribonukleaze, u čijoj tercijarnoj strukturi postoje četiri disulfidne veze; B - denaturirani molekul ribonukleaze;
B - oživljena molekula ribonukleaze sa smanjenom strukturom i funkcijom
1. Kompletna tabela 1.2.
Tabela 1.2. Klasifikacija aminokiselina prema polarnosti radikala
2. Napišite formulu tetrapeptida:
Asp - Pro - Fen - Liz
a) izolovati u peptidu ponavljajuće grupe koje formiraju peptidnu kičmu i varijabilne grupe predstavljene radikalima aminokiselina;
b) označiti N- i C-kraj;
c) podvuci peptidne veze;
d) napišite drugi peptid koji se sastoji od istih aminokiselina;
e) izbrojati broj mogućih varijanti tetrapeptida sa sličnim sastavom aminokiselina.
3. Objasnite ulogu primarne strukture proteina na primjeru komparativne analize dva strukturno slična i evolucijski bliska peptidna hormona neurohipofize sisara - oksitocina i vazopresina (tabela 1.3).
Tabela 1.3. Struktura i funkcija oksitocina i vazopresina
 Za ovo:
Za ovo:
a) uporediti sastav i sekvencu aminokiselina dva peptida;
b) pronaći sličnost primarne strukture dva peptida i sličnost njihovog biološkog djelovanja;
c) pronaći razlike u strukturi dva peptida i razliku u njihovim funkcijama;
d) izvući zaključak o uticaju primarne strukture peptida na njihove funkcije.
4. Opišite glavne faze u formiranju konformacije globularnih proteina (sekundarne, tercijarne strukture, koncept supersekundarne strukture). Navedite vrste veza koje su uključene u formiranje proteinskih struktura. Koji radikali aminokiselina mogu učestvovati u formiranju hidrofobnih interakcija, jonskih, vodoničnih veza.
Navedite primjere.
5. Dajte definiciju pojma "konformaciona labilnost proteina", navedite razloge njegovog postojanja i značaja.
6. Proširite značenje sljedeće fraze: "Funkcioniranje proteina se zasniva na njihovoj specifičnoj interakciji sa ligandom", koristeći izraze i objašnjavajući njihovo značenje: proteinska konformacija, aktivni centar, ligand, komplementarnost, funkcija proteina.
7. Koristite jedan primjer da objasnite šta su domeni i koja je njihova uloga u proteinima.
ZADACI ZA SAMOKONTROLU
1. Uspostavite korespondenciju.
Funkcionalna grupa u radikalu aminokiselina:
A. Karboksilna grupa B. Hidroksilna grupa C Gvanidinska grupa D. Tiol grupa D. Amino grupa
2. Odaberite tačne odgovore.
Aminokiseline sa polarnim nenabijenim radikalima su:
A. Cis B. Asn
B. Glu G. Tri
3. Odaberite tačne odgovore.
radikali aminokiselina:
A. Navedite specifičnost primarne strukture B. Učestvujte u formiranju tercijarne strukture
B. Nalazi se na površini proteina, utiču na njegovu rastvorljivost D. Formiraju aktivni centar
E. Učestvuje u formiranju peptidnih veza
4. Odaberite tačne odgovore.
Hidrofobne interakcije mogu nastati između radikala aminokiselina:
A. Tre Lei B. Pro Three
B. Met Ile G. Tir Ala D. Val Fen
5. Odaberite tačne odgovore.
Jonske veze mogu se formirati između radikala aminokiselina:
A. Gln Asp B. Apr Liz
B. Liz Glu G. Gies Asp D. Asn Apr
6. Odaberite tačne odgovore.
Vodikove veze mogu nastati između radikala aminokiselina:
A. Ser Gln B. Cis Tre
B. Asp Liz G. Glu Asp D. Asn Tre
7. Uspostavite korespondenciju.
Vrsta veze koja je uključena u formiranje strukture proteina:
A. Primarna struktura B. Sekundarna struktura
B. Tercijarna struktura
D. Supersekundarna struktura E. Konformacija.
1. Vodikove veze između atoma peptidne kičme
2. Slabe veze između funkcionalnih grupa radikala aminokiselina
3. Odnosi između α-amino i α-karboksilnih grupa aminokiselina
8. Odaberite tačne odgovore. tripsin:
A. Proteolitički enzim B. Sadrži dva domena
B. Hidrolizuje skrob
D. Aktivni centar se nalazi između domena. D. Sastoji se od dva polipeptidna lanca.
9. Odaberite tačne odgovore. atropin:
A. Neurotransmiter
B. Strukturni analog acetilholina
B. Interagira sa H-holinergičkim receptorima
D. Jača provodljivost nervnih impulsa kroz holinergičke sinapse
D. Kompetitivni inhibitor M-holinergičkih receptora
10. Odaberite tačne izjave. U proteinima:
A. Primarna struktura sadrži informacije o strukturi njenog aktivnog centra
B. Aktivni centar se formira na nivou primarne strukture
B. Konformacija je kruto fiksirana kovalentnim vezama
D. Aktivno mjesto može stupiti u interakciju sa grupom sličnih liganada
zbog konformacijske labilnosti proteina D. Promjene u okolini mogu uticati na afinitet aktivnog
centar za ligand
1.1-C, 2-D, 3-B.
3.A, B, C, D.
7.1-B, 2-D, 3-A.
8.A, B, C, D.
OSNOVNI POJMOVI I POJMOVI
1. Proteini, polipeptidi, aminokiseline
2. Primarna, sekundarna, tercijarna struktura proteina
3. Konformacija, nativna proteinska konformacija
4. Kovalentne i slabe veze u proteinu
5. Konformacijska labilnost
6. Aktivni centar proteina
7. Ligandi
8. Savijanje proteina
9. Strukturni analozi liganada
10. Proteini domena
11. Jednostavni i složeni proteini
12. Denaturacija proteina, denaturirajuća sredstva
13. Renoviranje proteina
Riješite zadatke
"Strukturna organizacija proteina i osnova njihovog funkcioniranja"
1. Glavna funkcija proteina, hemoglobina A (HbA), je transport kisika do tkiva. U ljudskoj populaciji poznati su višestruki oblici ovog proteina sa izmijenjenim svojstvima i funkcijama - takozvani abnormalni hemoglobini. Na primjer, otkriveno je da hemoglobin S, koji se nalazi u eritrocitima pacijenata sa anemijom srpastih stanica (HbS), ima nisku rastvorljivost u uslovima niskog parcijalnog pritiska kiseonika (kao što je slučaj u venskoj krvi). To dovodi do stvaranja agregata ovog proteina. Protein gubi svoju funkciju, taloži se, a eritrociti dobijaju nepravilan oblik (neki od njih formiraju srp) i uništavaju se brže nego inače u slezeni. Kao rezultat, razvija se anemija srpastih stanica.
Jedina razlika u primarnoj strukturi HbA pronađena je u N-terminalnom području β-lanca hemoglobina. Uporedite N-terminalne krajeve β-lanca i pokažite kako promjene u primarnoj strukturi proteina utiču na njegova svojstva i funkcije.
 Za ovo:
Za ovo:
a) napišite formule aminokiselina po kojima se HBA razlikuju i uporedite svojstva ovih aminokiselina (polaritet, naboj).
b) izvući zaključak o razlozima smanjenja rastvorljivosti i poremećaja transporta kiseonika u tkivu.
2. Na slici je prikazan dijagram strukture proteina koji ima mjesto vezanja liganda (aktivno mjesto). Objasnite zašto je protein selektivan u izboru liganda. Za ovo:
a) zapamtite šta je aktivni centar proteina i razmotrite strukturu aktivnog centra proteina prikazanu na slici;
b) napišite formule radikala aminokiselina koji čine aktivni centar;
c) nacrtati ligand koji bi mogao specifično stupiti u interakciju s aktivnim centrom proteina. Označite na njemu funkcionalne grupe sposobne da formiraju veze sa radikalima aminokiselina koji čine aktivni centar;
d) naznačiti tipove veza koje nastaju između liganda i aminokiselinskih radikala aktivnog centra;
e) objasniti na čemu se zasniva specifičnost interakcije proteina sa ligandom.
 3.
Slika prikazuje aktivno mjesto proteina i nekoliko liganada.
3.
Slika prikazuje aktivno mjesto proteina i nekoliko liganada.
Odredite koji od liganada će najvjerovatnije stupiti u interakciju s aktivnim mjestom proteina i zašto.
 Koje vrste veza nastaju tokom formiranja kompleksa protein-ligand?
Koje vrste veza nastaju tokom formiranja kompleksa protein-ligand?
4. Strukturni analozi prirodnih proteinskih liganda mogu se koristiti kao lijekovi za promjenu aktivnosti proteina.
Acetilholin je prenosilac ekscitacije u neuromuskularnim sinapsama. Kada acetilholin stupi u interakciju s proteinima - receptorima postsinaptičke membrane skeletnih mišića, otvaraju se jonski kanali i dolazi do kontrakcije mišića. Ditilin je lijek koji se koristi u nekim operacijama za opuštanje mišića, jer remeti prijenos nervnih impulsa kroz neuromišićne sinapse. Objasniti mehanizam djelovanja ditilina kao lijeka za relaksaciju mišića. Za ovo:
a) napišite formule acetilholina i ditilina i uporedite njihove strukture;
b) opisati mehanizam opuštajućeg djelovanja ditilina.
5. Kod nekih bolesti dolazi do porasta tjelesne temperature pacijenta, što se smatra zaštitnom reakcijom tijela. Međutim, visoke temperature su štetne za proteine u tijelu. Objasnite zašto se na temperaturama iznad 40°C poremeti funkcija proteina i nastaje opasnost po život ljudi. Da biste to učinili, zapamtite:
1) Struktura proteina i veza koje drže njegovu strukturu u prirodnoj konformaciji;
2) Kako se struktura i funkcija proteina mijenja sa porastom temperature?;
3) Šta je homeostaza i zašto je važna za očuvanje zdravlja ljudi.
Modularna jedinica 2 OLIGOMERNI PROTEINI KAO CILJE REGULATORNOG UTICAJA. STRUKTURALNA I FUNKCIONALNA VARNOST PROTEINA. METODE SEPARACIJE I PROČIŠĆAVANJA PROTEINA
Ciljevi učenja Biti u stanju:
1. Iskoristite znanje o karakteristikama strukture i funkcijama oligomernih proteina da biste razumjeli adaptivne mehanizme regulacije njihovih funkcija.
2. Objasniti ulogu pratioca u sintezi i održavanju proteinske konformacije u ćelijskim uslovima.
3. Objasnite raznolikost manifestacija života raznolikošću struktura i funkcija proteina koji se sintetiziraju u tijelu.
4. Analizirati vezu između strukture proteina i njihove funkcije na primjerima poređenja srodnih hemoproteina - mioglobina i hemoglobina, kao i predstavnika pet klasa proteina porodice imunoglobulina.
5. Primijeniti znanje o posebnostima fizičko-hemijskih svojstava proteina za odabir metoda za njihovo prečišćavanje od drugih proteina i nečistoća.
6. Interpretirajte rezultate kvantitativnog i kvalitativnog sastava proteina krvne plazme kako biste potvrdili ili razjasnili kliničku dijagnozu.
znati:
1. Osobine strukture oligomernih proteina i adaptivni mehanizmi regulacije njihovih funkcija na primjeru hemoglobina.
2. Struktura i funkcija šaperona i njihov značaj za održavanje prirodne konformacije proteina u ćelijskim uslovima.
3. Principi kombinovanja proteina u porodice prema sličnosti njihove konformacije i funkcija na primjeru imunoglobulina.
4. Metode odvajanja proteina na osnovu posebnosti njihovih fizičko-hemijskih svojstava.
5. Elektroforeza krvne plazme kao metoda za određivanje kvalitativnog i kvantitativnog sastava proteina.
TEMA 1.4. OSOBINE STRUKTURE I FUNKCIONISANJA OLIGOMERNIH PROTEINA NA PRIMJERU HEMOGLOBINA
1. Mnogi proteini sadrže nekoliko polipeptidnih lanaca. Takvi proteini se nazivaju oligomerni, i pojedinačni lanci - protomeri. Protomeri u oligomernim proteinima povezani su mnogim slabim nekovalentnim vezama (hidrofobne, jonske, vodikove). Interakcija
protomers se vrši zahvaljujući komplementarnost njihove kontaktne površine.
Broj protomera u oligomernim proteinima može značajno varirati: hemoglobin sadrži 4 protomera, enzim aspartat aminotransferaze sadrži 12 protomera, a protein virusa mozaika duhana sadrži 2.120 protomera povezanih nekovalentnim vezama. Posljedično, oligomerni proteini mogu imati vrlo visoke molekularne težine.
Interakcija jednog protomera sa drugim može se smatrati posebnim slučajem interakcije proteina sa ligandom, jer svaki protomer služi kao ligand za druge protomere. Broj i način kombinovanja protomera u proteinu se naziva kvarterna struktura proteina.
Proteini mogu uključivati protomere iste ili različite strukture, na primjer, homodimeri su proteini koji sadrže dva identična protomera, a heterodimeri su proteini koji sadrže dva različita protomera.
Ako proteini sadrže različite protomere, na njima se mogu formirati različite strukture veznih mjesta s različitim ligandima. Kada se ligand veže za aktivni centar, očituje se funkcija ovog proteina. Centar koji se nalazi na drugom protomeru naziva se alosteričan (osim aktivnog). Kontaktiranje alosterični ligand ili efektor, vrši regulatornu funkciju (slika 1.18). Interakcija alosteričkog centra sa efektorom uzrokuje konformacijske promjene u strukturi cjelokupnog oligomernog proteina zbog njegove konformacijske labilnosti. Ovo utiče na afinitet aktivnog mesta za određeni ligand i reguliše funkciju ovog proteina. Promjena konformacije i funkcije svih protomera nakon interakcije oligomernog proteina s barem jednim ligandom naziva se kooperativne konformacijske promjene. Zovu se efektori koji poboljšavaju funkciju proteina aktivatori, i efektori koji inhibiraju njegovu funkciju - inhibitori.
Dakle, oligomerni proteini, kao i proteini sa domenskom strukturom, imaju novo svojstvo u poređenju sa monomernim proteinima - sposobnost alosterične regulacije funkcija (regulacija vezivanjem različitih liganada za protein). To se može vidjeti poređenjem struktura i funkcija dva blisko povezana kompleksna proteina, mioglobina i hemoglobina.
 Rice. 1.18. Dimerni dijagram strukture proteina
Rice. 1.18. Dimerni dijagram strukture proteina
2. Formiranje prostornih struktura i funkcioniranje mioglobina.
Mioglobin (MB) je protein koji se nalazi u crvenim mišićima, čija je glavna funkcija stvaranje rezervi O 2 koje su neophodne za intenzivan rad mišića. MB je kompleksni protein koji sadrži proteinski dio - apoMv i neproteinski dio - hem. Primarna struktura apoMv određuje njegovu kompaktnu globularnu konformaciju i strukturu aktivnog mjesta za koje je vezan neproteinski dio mioglobina, hem. Kiseonik koji dolazi iz krvi u mišiće vezuje se za Fe + 2 hem u mioglobinu. MB je monomerni protein sa vrlo visokim afinitetom za O 2, pa se oslobađanje kiseonika mioglobinom dešava samo tokom intenzivnog mišićnog rada, kada parcijalni pritisak O 2 naglo opadne.
Formiranje MB konformacije. U crvenim mišićima na ribosomima, tokom translacije, sintetiše se primarna struktura MB, predstavljena specifičnom sekvencom od 153 aminokiselinska ostatka. Sekundarna struktura MB sadrži osam α-heliksa, nazvanih latiničnim slovima od A do H, između kojih se nalaze ne-helikalni dijelovi. Tercijarna struktura MB ima oblik kompaktne globule, u čijem se produbljivanju između F i E α-heliksa nalazi aktivni centar (slika 1.19).
 Rice. 1.19. Struktura mioglobina
Rice. 1.19. Struktura mioglobina
3. Osobine strukture i funkcionisanja aktivnog centra Mv. Aktivni centar MB formiraju uglavnom hidrofobni radikali aminokiselina, koji su u primarnoj strukturi udaljeni jedan od drugog (na primjer, Tri 3 9 i Fen 138) Ligandi slabo rastvorljivi u vodi - hem i O 2 - vezani su za aktivni centar. Hem je specifični ligand apoMv (slika 1.20), koji se zasniva na četiri pirolna prstena povezana metenilnim mostovima; atom Fe + 2 nalazi se u centru, povezan sa atomima azota pirolnih prstenova pomoću četiri koordinacione veze. U aktivnom centru MB, pored hidrofobnih aminokiselinskih radikala, nalaze se i ostaci dvije aminokiseline sa hidrofilnim radikalima - Gis E 7(Gis 64) i Njegov F 8(Gis 93) (sl. 1.21).
 Rice. 1.20. Struktura hema - neproteinski dio mioglobina i hemoglobina
Rice. 1.20. Struktura hema - neproteinski dio mioglobina i hemoglobina
 Rice. 1.21. Lokacija hema i O 2 u aktivnom centru apomioglobina i protomera hemoglobina
Rice. 1.21. Lokacija hema i O 2 u aktivnom centru apomioglobina i protomera hemoglobina
Hem je preko atoma gvožđa kovalentno vezan za His F 8. O 2 se vezuje za žlezdu sa druge strane ravni hema. Njegov E 7 je neophodan za ispravnu orijentaciju O 2 i olakšava dodavanje kisika Fe + 2 hemu
Njegov F 8 formira koordinacionu vezu sa Fe + 2 i čvrsto fiksira hem u aktivnom centru. Gis E 7 je neophodan za ispravnu orijentaciju u aktivnom centru drugog liganda, O 2, kada je u interakciji sa Fe + 2 hemom. Mikrookolina hema stvara uslove za snažno ali reverzibilno vezivanje O 2 sa Fe + 2 i sprečava ulazak vode u hidrofobni aktivni centar, što može dovesti do njegove oksidacije u Fe + 3.
Monomerna struktura MB i njegovog aktivnog centra određuju visok afinitet proteina za O 2.
4. Oligomerna struktura HB i regulacija afiniteta HB za O 2 ligande. Ljudski hemoglobini- porodica proteina, kao i mioglobin srodan kompleksnim proteinima (hemoproteini). Imaju tetramernu strukturu i sadrže dva α-lanca, ali se razlikuju po strukturi druga dva polipeptidna lanca (2α-, 2x-lanci). Struktura drugog polipeptidnog lanca određuje karakteristike funkcionisanja ovih oblika HB. Oko 98% hemoglobina eritrocita odrasle osobe je hemoglobin A(2α-, 2p-lanci).
U periodu intrauterinog razvoja postoje dvije glavne vrste hemoglobina: embrionalni HB(2α, 2ε), koji se nalazi u ranim fazama fetalnog razvoja, i hemoglobin F (fetalni)- (2α, 2γ), koji zamjenjuje rani fetalni hemoglobin u šestom mjesecu intrauterinog razvoja i tek nakon rođenja zamjenjuje se HB A.
HB A je protein vezan za mioglobin (MB) i nalazi se u eritrocitima odrasle osobe. Struktura njegovih pojedinačnih protomera slična je strukturi mioglobina. Sekundarne i tercijarne strukture protomera mioglobina i hemoglobina su vrlo slične, uprkos činjenici da su u primarnoj strukturi njihovih polipeptidnih lanaca samo 24 aminokiselinska ostatka identične (sekundarna struktura protomera hemoglobina, poput mioglobina, sadrži osam α-heliksa, označeno latiničnim slovima od A do H, a tercijarna struktura izgleda kao kompaktna globula). Ali za razliku od mioglobina, hemoglobin ima oligomernu strukturu, sastoji se od četiri polipeptidna lanca povezana nekovalentnim vezama (slika 1.22).
Svaki HB protomer povezan je s ne-proteinskim dijelom — hemom i susjednim protomerima. Veza proteinskog dijela HB sa hemom slična je onoj kod mioglobina: u aktivnom centru proteina, hidrofobni dijelovi hema su okruženi hidrofobnim radikalima aminokiselina, s izuzetkom His F 8 i His E 7 , koji se nalaze sa obe strane ravni hema i igraju sličnu ulogu u funkcionisanju proteina i njegovom vezivanju sa kiseonikom (vidi strukturu mioglobina).
 Rice. 1.22. Oligomerna struktura hemoglobina
Rice. 1.22. Oligomerna struktura hemoglobina
Štaviše, Gis E 7 ispunjava važnu dodatnu ulogu u funkcionisanju NV. Slobodni hem ima 25.000 puta veći afinitet za CO nego za O2. CO se stvara u malim količinama u tijelu i, s obzirom na visok afinitet za hem, mogao bi poremetiti transport O2 neophodnog za život ćelija. Međutim, u sastavu hemoglobina, afinitet hema prema ugljičnom monoksidu premašuje afinitet za O 2 samo 200 puta zbog prisustva His E 7 u aktivnom centru. Ostatak ove aminokiseline stvara optimalne uslove da se hem veže za O2 i slabi interakciju hema sa CO.
5. Glavna funkcija HB je transport O2 iz pluća u tkivo. Za razliku od monomernog mioglobina, koji ima vrlo visok afinitet prema O 2 i obavlja funkciju skladištenja kisika u crvenim mišićima, oligomerna struktura hemoglobina osigurava:
1) brzo zasićenje Hb kiseonikom u plućima;
2) sposobnost HB da donira kiseonik u tkivima pri relativno visokom parcijalnom pritisku od O 2 (20-40 mm Hg);
3) sposobnost regulacije afiniteta HB prema O2.
6. Kooperativne promjene u konformaciji protomera hemoglobina ubrzavaju vezivanje O 2 u plućima i njegovo oslobađanje u tkiva. U plućima, visoki parcijalni pritisak O2 promoviše njegovo vezivanje za HB u aktivnom centru četiri protomera (2α i 2β). Aktivni centar svakog protomera, kao u mioglobinu, nalazi se između dvije α-heliksa (F i E) u hidrofobnom džepu. Sadrži neproteinski dio - hem, vezan za proteinski dio mnogim slabim hidrofobnim interakcijama i jednu jaku vezu između Fe 2 + hema i His F 8 (vidi sliku 1.21).
U deoksihemoglobinu, zbog ove veze sa His F 8, atom Fe 2 + strši iz ravni hema prema histidinu. Vezivanje O 2 sa Fe 2 + događa se na drugoj strani hema u području His E 7 uz pomoć jedne slobodne koordinacione veze. Gis E 7 pruža optimalne uslove za vezivanje O 2 za hem gvožđe.
Vezanje O 2 za Fe +2 atom jednog protomera uzrokuje njegovo pomicanje u ravan hema, praćeno ostatkom histidina koji je vezan za njega.
 Rice. 1.23. Promjena konformacije protomera hemoglobina u kombinaciji s O2
Rice. 1.23. Promjena konformacije protomera hemoglobina u kombinaciji s O2
To dovodi do promjene u konformaciji svih polipeptidnih lanaca zbog njihove konformacijske labilnosti. Promjena konformacije drugih lanaca olakšava njihovu interakciju sa sljedećim molekulima O2.
Četvrti molekul O 2 se veže za hemoglobin 300 puta lakše od prvog (slika 1.24).
 Rice. 1.24. Kooperativne promjene u konformaciji protomera hemoglobina tokom njegove interakcije sa O 2
Rice. 1.24. Kooperativne promjene u konformaciji protomera hemoglobina tokom njegove interakcije sa O 2
U tkivima se svaki naredni O 2 molekul lakše odcjepljuje od prethodnog, također zbog kooperativnih promjena u konformaciji protomera.
7. CO 2 i H +, nastali tokom katabolizma organskih supstanci, smanjuju afinitet hemoglobina prema O 2 proporcionalno njihovoj koncentraciji. Energija potrebna za funkcionisanje ćelija proizvodi se uglavnom u mitohondrijima tokom oksidacije organskih supstanci pomoću O 2 koji se isporučuje iz pluća hemoglobinom. Kao rezultat oksidacije organskih tvari nastaju konačni produkti njihovog raspada: CO 2 i K 2 O, čija je količina proporcionalna intenzitetu tekućih oksidacijskih procesa.
CO 2 difuzijom iz stanica u krv i prodire u eritrocite, gdje se pod djelovanjem enzima karbanhidraze pretvara u ugljičnu kiselinu. Ova slaba kiselina disocira u proton i bikarbonatni ion.
H + su u stanju da se pridruže Hisovim radikalima 14 6 u α- i β-lancima hemoglobina, tj. u područjima udaljenim od hema. Protoniranje hemoglobina smanjuje njegov afinitet za O 2, pospješuje eliminaciju O 2 iz oksiHb, stvaranje deoksiHb i povećava opskrbu tkiva kisikom srazmjerno broju nastalih protona (slika 1.25).
Povećanje količine oslobođenog kiseonika u zavisnosti od povećanja koncentracije H+ u eritrocitima naziva se Bohrov efekat (po danskom fiziologu Christianu Boru, koji je prvi otkrio ovaj efekat).
U plućima, visok parcijalni pritisak kiseonika pospešuje njegovo vezivanje sa deoksiHB, što smanjuje afinitet proteina za H+. Oslobođeni protoni pod dejstvom karboanhidraze stupaju u interakciju sa bikarbonatima i formiraju SO 2 i N 2 O

 Rice. 1.25. Ovisnost afiniteta Hb za O 2 o koncentraciji CO 2 i protona (Bohrov efekat):
Rice. 1.25. Ovisnost afiniteta Hb za O 2 o koncentraciji CO 2 i protona (Bohrov efekat):
A- uticaj koncentracije CO 2 i H + na oslobađanje O 2 iz kompleksa sa HB (Bohrov efekat); B- oksigenacija deoksihemoglobina u plućima, stvaranje i oslobađanje CO2.
Nastali CO 2 ulazi u alveolarni prostor i uklanja se izdahnutim zrakom. Dakle, količina kisika koji hemoglobin oslobađa u tkivima regulirana je produktima katabolizma organskih tvari: što je intenzivnija razgradnja tvari, na primjer, tokom fizičkog napora, to je veća koncentracija CO 2 i H + i više kiseonika tkiva dobijaju kao rezultat smanjenja afiniteta Hb prema O2.
8. Alosterična regulacija afiniteta Hb za O 2 pomoću liganda - 2,3-bis-fosfoglicerat. U eritrocitima se iz produkta oksidacije glukoze, 1,3-bisfosfoglicerata, sintetiše alosterični ligand hemoglobina, 2,3-bisfosfoglicerat (2,3-BFG). U normalnim uslovima, koncentracija 2,3-BFG je visoka i uporediva sa koncentracijom HB. 2,3-BFG ima jak negativni naboj od -5.
 Bisfosfoglicerat u tkivnim kapilarima, vezujući se za deoksihemoglobin, povećava oslobađanje kisika u tkivu, smanjujući afinitet HB za O2.
Bisfosfoglicerat u tkivnim kapilarima, vezujući se za deoksihemoglobin, povećava oslobađanje kisika u tkivu, smanjujući afinitet HB za O2.
U središtu tetramernog molekula hemoglobina postoji šupljina. Formiran je od aminokiselinskih ostataka sva četiri protomera (vidi sliku 1.22). U kapilarama tkiva protonacija HB (Bohrov efekat) dovodi do prekida veze između hem gvožđa i O2. U molekulu
deoksihemoglobin, u poređenju sa oksihemoglobinom, nastaju dodatne jonske veze koje povezuju protomere, usled čega se dimenzije centralne šupljine povećavaju u odnosu na oksihemoglobin. Centralna šupljina je mjesto gdje se 2,3-BFG vezuje za hemoglobin. Zbog razlike u veličini centralne šupljine, 2,3-BFG se može vezati samo za deoksihemoglobin.
2,3-BFG stupa u interakciju s hemoglobinom u regiji udaljenoj od aktivnih centara proteina i pripada alosterični(regulatorni) ligandi, a centralna šupljina HB je alosterični centar. 2,3-BFG ima snažan negativni naboj i u interakciji je sa pet pozitivno nabijenih grupa dva β-lanca HB: N-terminalnom α-amino grupom Val i radikalima Lys 82 His 143 (slika 1.26).
 Rice. 1.26. BPH u centralnoj šupljini deoksihemoglobina
Rice. 1.26. BPH u centralnoj šupljini deoksihemoglobina
BPH se vezuje za tri pozitivno nabijene grupe u svakom β-lancu.
U kapilarama tkiva nastali deoksihemoglobin stupa u interakciju sa 2,3-BFG i formiraju se ionske veze između pozitivno nabijenih radikala β-lanaca i negativno nabijenog liganda, koji mijenjaju konformaciju proteina i smanjuju afinitet HB za O 2. Smanjenje afiniteta Hb za O 2 doprinosi efikasnijem oslobađanju O 2 u tkivo.
U plućima, pri visokom parcijalnom pritisku, kiseonik stupa u interakciju sa HB, vezujući se za hem gvožđe; istovremeno se menja konformacija proteina, smanjuje se centralna šupljina i 2,3-BFG se pomera iz alosteričnog centra
Dakle, oligomerni proteini imaju nova svojstva u poređenju sa monomernim proteinima. Vezanje liganada na mjestima
prostorno udaljene jedna od druge (alosterične), sposobne da izazovu konformacijske promjene u cijeloj proteinskoj molekuli. Zbog interakcije s regulatornim ligandima, konformacija se mijenja i funkcija proteinske molekule se prilagođava promjenama u okolini.
TEMA 1.5. ODRŽAVANJE KONFORMACIJE NATIVNIH PROTEINA U ĆELIJSKIM USLOVIMA
U ćelijama, tokom sinteze polipeptidnih lanaca, njihov transport preko membrana do odgovarajućih delova ćelije, tokom savijanja (formiranje nativne konformacije) i tokom sastavljanja oligomernih proteina, kao i tokom njihovog funkcionisanja, intermedijernih, sklonih do agregacije, pojavljuju se nestabilne konformacije u strukturi proteina. Hidrofobni radikali, u prirodnoj konformaciji obično skriveni unutar proteinske molekule, nalaze se na površini u nestabilnoj konformaciji i imaju tendenciju da se kombinuju sa istim grupama drugih proteina koji su slabo rastvorljivi u vodi. U ćelijama svih poznatih organizama pronađeni su posebni proteini koji obezbeđuju optimalno savijanje ćelijskih proteina, stabilizuju njihovu nativnu konformaciju tokom funkcionisanja i, što je najvažnije, održavaju strukturu i funkciju intracelularnih proteina u slučaju poremećaja homeostaze. Ovi proteini su imenovani "Šaperoni",što na francuskom znači "dadilja".
1. Molekularni šaperoni i njihova uloga u sprječavanju denaturacije proteina.
Šaperoni (III) su klasifikovani prema masi podjedinica. Šaperoni visoke molekularne težine imaju masu od 60 do 110 kDa. Među njima su tri klase najviše proučavane: Sh-60, Sh-70 i Sh-90. Svaka klasa uključuje porodicu srodnih proteina. Dakle, sastav III-70 uključuje proteine molekularne težine od 66 do 78 kDa. Šaperoni niske molekularne težine imaju molekulsku težinu od 40 do 15 kDa.
Među pratiocima se razlikuju konstitutivni proteini, čija visoka bazalna sinteza ne zavisi od uticaja stresa na ćelije tela, i inducibilno,čija je sinteza u normalnim uslovima slaba, ali se naglo povećava pod stresom. Inducibilni chaperoni se također nazivaju "proteini toplotnog šoka" jer su prvi put otkriveni u ćelijama izloženim visokim temperaturama. U ćelijama, zbog visoke koncentracije proteina, otežano je spontano obnavljanje delimično denaturisanih proteina. III-70 može spriječiti početni proces denaturacije i pomoći u obnavljanju prirodne konformacije proteina. Molekularni pratioci-70- visoko konzervirana klasa proteina koja se nalazi u svim dijelovima ćelije: citoplazma, jezgro, endoplazmatski retikulum, mitohondrije. Na karboksilnom kraju jedinog III-70 polipeptidnog lanca, postoji regija koja je žljeb sposoban za interakciju s peptidima dužine
od 7 do 9 aminokiselinskih ostataka obogaćenih hidrofobnim radikalima. Takve regije u globularnim proteinima se javljaju otprilike na svakih 16 aminokiselina. III-70 mogu zaštititi proteine od temperaturne inaktivacije i vratiti konformaciju i aktivnost djelomično denaturiranih proteina.
2. Uloga chaperona u savijanju proteina. Kada se proteini sintetišu na ribosomu, N-terminalni region polipeptida se sintetiše ranije od C-terminalnog regiona. Potpuna aminokiselinska sekvenca proteina potrebna je za formiranje nativne konformacije. U procesu sinteze proteina, šaperoni-70, zbog strukture svog aktivnog centra, mogu zatvoriti regije sklone agregaciji polipeptida obogaćene hidrofobnim radikalima aminokiselina dok se sinteza ne završi (slika 1.27, A).
 Rice. 1.27. Učešće pratilaca u savijanju proteina
Rice. 1.27. Učešće pratilaca u savijanju proteina
A - učešće šaperona-70 u prevenciji hidrofobnih interakcija između regiona sintetizovanog polipeptida; B - formiranje nativne proteinske konformacije u kompleksu šaperona
Mnogi proteini visoke molekularne težine sa složenom konformacijom, na primjer, strukturom domena, savijaju se u posebnom prostoru formiranom od III-60. Sh-60 funkcioniraju kao oligomerni kompleks koji se sastoji od 14 podjedinica. Oni formiraju dva šuplja prstena, od kojih se svaki sastoji od sedam podjedinica, ti prstenovi su međusobno povezani. Svaka III-60 podjedinica se sastoji od tri domena: apikalnog (apikalnog), obogaćenog hidrofobnim radikalima okrenutim ka šupljini prstena, srednjeg i ekvatorijalnog (slika 1.28).
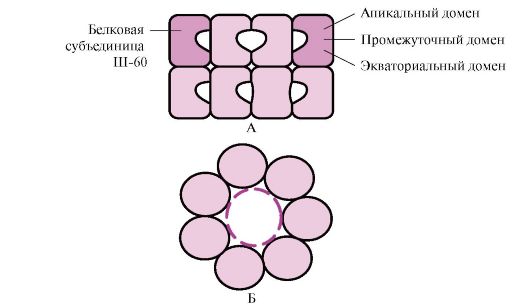 Rice. 1.28. Struktura kompleksa šaperonina koji se sastoji od 14 Sh-60
Rice. 1.28. Struktura kompleksa šaperonina koji se sastoji od 14 Sh-60
A - pogled sa strane; B - pogled odozgo
Sintetizirani proteini, koji na površini imaju elemente koji su karakteristični za nesavijene molekule, posebno hidrofobne radikale, ulaze u šupljinu šaperonskih prstenova. U specifičnom okruženju ovih šupljina dolazi do nabrajanja mogućih konformacija dok se ne pronađe jedina, energetski najpovoljnija (slika 1.27, B). Formiranje konformacija i oslobađanje proteina je praćeno hidrolizom ATP-a u ekvatorijalnom području. Tipično, takvo savijanje ovisno o šaperonu zahtijeva značajnu količinu energije.
Osim što učestvuju u formiranju trodimenzionalne strukture proteina i oživljavanju djelomično denaturiranih proteina, chaperoni su također potrebni za takve fundamentalne procese kao što su sklapanje oligomernih proteina, prepoznavanje i transport denaturiranih proteina u lizozome, transport proteina preko membrana, i učešće u regulaciji aktivnosti proteinskih kompleksa.
TEMA 1.6. RAZNOLIKE PROTEINA. PORODICE PROTEINA NA PRIMJERU IMUNOGLOBULINA
1. Proteini igraju odlučujuću ulogu u životu pojedinih ćelija i čitavog višećelijskog organizma, a njihove funkcije su iznenađujuće raznolike. Ovo je određeno karakteristikama primarne strukture i konformacija proteina, jedinstvenošću strukture aktivnog centra i sposobnošću vezivanja specifičnih liganada.
Samo vrlo mali dio svih mogućih varijanti peptidnih lanaca može pretpostaviti stabilnu prostornu strukturu; većina
od njih mogu uzeti mnoge konformacije sa približno istom Gibbsovom energijom, ali s različitim svojstvima. Primarna struktura većine poznatih proteina odabranih biološkom evolucijom pruža izuzetnu stabilnost jedne od konformacija koje određuju posebnosti funkcionisanja ovog proteina.
2. Porodice proteina. Unutar iste biološke vrste, zamjene aminokiselinskih ostataka mogu dovesti do pojave različitih proteina koji obavljaju srodne funkcije i imaju homologne sekvence aminokiselina. Takvi srodni proteini imaju zapanjujuće slične konformacije: broj i interpozicija α-heliksa i/ili β-struktura, većina zavoja i krivina polipeptidnih lanaca su slični ili identični. Proteini sa homolognim regionima polipeptidnog lanca, sličnom konformacijom i srodnim funkcijama izolovani su u porodice proteina. Primjeri porodica proteina: serinske proteinaze, porodica imunoglobulina, porodica mioglobina.
Serine Proteinases- porodica proteina koji obavljaju funkciju proteolitičkih enzima. To uključuje probavne enzime - himotripsin, tripsin, elastazu i mnoge faktore zgrušavanja krvi. Ovi proteini imaju identične aminokiseline u 40% položaja i vrlo blisku konformaciju (slika 1.29).

Rice. 1.29. Prostorne strukture elastaze (A) i kimotripsina (B)
Neke zamjene aminokiselina dovele su do promjene specifičnosti supstrata ovih proteina i pojave funkcionalne raznolikosti unutar porodice.
3. Porodica imunoglobulina. Proteini superfamilije imunoglobulina, koja uključuje tri porodice proteina, igraju veliku ulogu u funkcionisanju imunog sistema:
Antitijela (imunoglobulini);
T-limfocitni receptori;
Proteini glavnog kompleksa histokompatibilnosti - MHC klase 1 i 2 (Major Histocompatibility Complex).
Svi ovi proteini imaju domensku strukturu, sastoje se od homolognih imunosnih domena i obavljaju slične funkcije: u interakciji su sa stranim strukturama, bilo otopljenim u krvi, limfi ili međućelijskoj tekućini (antitijela), ili lociranim na površini ćelija (vlastita ili stranih).
4. Antitijela- specifični proteini koje proizvode B-limfociti kao odgovor na ulazak strane strukture u tijelo, tzv antigen.
Karakteristike strukture antitijela
Najjednostavniji molekuli antitijela sastoje se od četiri polipeptidna lanca: dva identična laka - L, koja sadrže oko 220 aminokiselina, i dva identična teška - H, koja se sastoje od 440-700 aminokiselina. Sva četiri lanca u molekulu antitijela povezana su mnogim nekovalentnim vezama i četiri disulfidne veze (slika 1.30).
Laki lanci antitijela sastoje se od dva domena: varijabilnog (VL), smještenog u N-terminalnom području polipeptidnog lanca, i konstantnog (CL), smještenog na C-terminusu. Teški lanci obično imaju četiri domena: jedan varijabilni (VH) koji se nalazi na N-terminusu i tri konstantna (CH1, CH2, CH3) (vidi sliku 1.30). Svaka domena imunoglobulina ima β-listu superstrukturu u kojoj su dva cisteinska ostatka povezana disulfidnom vezom.
Između dva konstantna domena CH1 i CH2 nalazi se region koji sadrži veliki broj prolinskih ostataka, koji sprečavaju stvaranje sekundarne strukture i interakciju susednih H lanaca u ovom segmentu. Ovaj zglobni region pruža fleksibilnost molekulu antitijela. Između varijabilnih domena teškog i lakog lanca nalaze se dva identična mjesta za vezivanje antigena (aktivna mjesta za vezivanje antigena), stoga se takva antitijela često nazivaju bivalenti. Nije cela aminokiselinska sekvenca varijabilnih regiona oba lanca uključena u vezivanje antigena za antitelo, već samo 20-30 amino kiselina koje se nalaze u hipervarijabilnim regionima svakog lanca. Upravo ti regioni određuju jedinstvenu sposobnost svakog tipa antitela da interaguje sa odgovarajućim komplementarnim antigenom.
Antitijela su jedna od linija odbrane tijela od invazije stranih organizama. Njihovo funkcioniranje se može podijeliti u dvije faze: prva faza je prepoznavanje i vezivanje antigena na površini stranih organizama, što je moguće zbog prisustva mjesta za vezivanje antigena u strukturi antitijela; druga faza je pokretanje procesa inaktivacije i uništavanja antigena. Specifičnost druge faze zavisi od klase antitela. Postoji pet klasa teških lanaca, koji se međusobno razlikuju po strukturi konstantnih domena: α, δ, ε, γ i μ, prema kojima se razlikuje pet klasa imunoglobulina: A, D, E, G i M .
Strukturne karakteristike teških lanaca daju zglobnim regionima i C-terminalnim regionima teških lanaca konformaciju karakterističnu za svaku klasu. Nakon vezivanja antigena za antitelo, konformacione promene u konstantnim domenima određuju put uklanjanja antigena.
 Rice. 1.30 Struktura domena IgG
Rice. 1.30 Struktura domena IgG
Imunoglobulini M
Imunoglobulini M imaju dva oblika.
Monomerni oblik- 1. klasa antitela koje proizvodi B-limfocit u razvoju. Nakon toga, mnoge B ćelije prelaze na proizvodnju drugih klasa antitela, ali sa istim mestom za vezivanje antigena. IgM se ugrađuje u membranu i djeluje kao receptor za prepoznavanje antigena. Ugradnja IgM u ćelijsku membranu je moguća zbog prisustva 25 hidrofobnih aminokiselinskih ostataka u repnom dijelu regije.
Sekretorni oblik IgM sadrži pet monomernih podjedinica povezanih jedna s drugom disulfidnim vezama i dodatni polipeptidni J-lanac (slika 1.31). Teški lanci monomera ovog oblika ne sadrže hidrofobni rep. Pentamer ima 10 mjesta za vezivanje antigena i stoga je efikasan u prepoznavanju i uklanjanju antigena koji je prvi put ušao u tijelo. Sekretorni oblik IgM je glavna klasa antitijela koja se izlučuju u krvotok tokom primarnog imunološkog odgovora. Vezivanje IgM za antigen menja konformaciju IgM i indukuje njegovo vezivanje za prvu proteinsku komponentu sistema komplementa (sistem komplementa je skup proteina uključenih u uništavanje antigena) i aktivira ovaj sistem. Ako se antigen nalazi na površini mikroorganizma, sistem komplementa uzrokuje narušavanje integriteta ćelijske membrane i smrt bakterijske ćelije.
Imunoglobulini G
U kvantitativnom smislu, ova klasa imunoglobulina dominira u krvi (75% svih Ig). IgG - monomeri, glavna klasa antitela, koja se luče u krvotok tokom sekundarnog imunološkog odgovora. Nakon interakcije IgG sa površinskim antigenima mikroorganizama, kompleks antigen-antitelo je u stanju da veže i aktivira proteine sistema komplementa ili može da stupi u interakciju sa specifičnim receptorima makrofaga i neutrofila. Interakcija sa fagocitima vodi
 Rice. 1.31. Struktura sekretornog oblika IgM
Rice. 1.31. Struktura sekretornog oblika IgM
na apsorpciju kompleksa antigen-antitijelo i njihovo uništavanje u fagosomima stanica. IgG je jedina klasa antitijela koja mogu proći placentnu barijeru i pružiti intrauterinu zaštitu fetusa od infekcija.
Imunoglobulini A
Glavna klasa antitijela prisutna u izlučevinama (mlijeko, pljuvačka, respiratorni i crijevni sekret). IgA se izlučuje uglavnom u dimernom obliku, gde su monomeri međusobno povezani preko dodatnog J-lanca (slika 1.32).
IgA ne stupa u interakciju sa sistemom komplementa i fagocitnim ćelijama, ali vezujući se za mikroorganizme, antitela sprečavaju njihovo vezivanje za epitelne ćelije i prodiranje u organizam.
Imunoglobulini E
Imunoglobulini E su predstavljeni monomerima u kojima teški ε-lanci sadrže, poput μ-lanaca imunoglobulina M, jedan varijabilni i četiri konstantna domena. IgE se, nakon izlučivanja, vezuju
 Rice. 1.32. IgA struktura
Rice. 1.32. IgA struktura
C-terminalna mjesta sa odgovarajućim receptorima na površini mastocita i bazofila. Kao rezultat, oni postaju receptori za antigene na površini ovih ćelija (slika 1.33).
 Rice. 1.33. Interakcija IgE sa antigenom na površini mastocita
Rice. 1.33. Interakcija IgE sa antigenom na površini mastocita
Nakon što se antigen veže na odgovarajuća mjesta vezanja antigena IgE, stanice primaju signal za lučenje biološki aktivnih supstanci (histamin, serotonin) koje su u velikoj mjeri odgovorne za razvoj upalne reakcije i ispoljavanje alergijskih reakcija. kao što su astma, urtikarija, peludna groznica.
Imunoglobulini D
Imunoglobulini D se nalaze u serumu u vrlo malim količinama, oni su monomeri. Teški δ-lanci imaju jedan varijabilni i tri konstantna domena. IgD djeluje kao receptor za B-limfocite, druge funkcije su još uvijek nepoznate. Interakcija specifičnih antigena sa receptorima na površini B-limfocita (IgD) dovodi do prenošenja ovih signala u ćeliju i aktiviranja mehanizama koji osiguravaju umnožavanje ovog klona limfocita.
TEMA 1.7. FIZIČKA I HEMIJSKA SVOJSTVA PROTEINA I NAČINI NJIHOVOG ODJELJAVANJA
1. Pojedini proteini se razlikuju po svojim fizičkim i hemijskim svojstvima:
Oblik molekula;
Molekularna težina;
Ukupni naboj, čija vrijednost ovisi o omjeru anjonske i kationske grupe aminokiselina;
Odnos polarnih i nepolarnih radikala aminokiselina na površini molekula;
Stepen otpornosti na djelovanje različitih denaturirajućih agenasa.
2. Rastvorljivost proteina zavisi na svojstva gore navedenih proteina, kao i na sastav medijuma u kojem je protein otopljen (pH vrijednost, sastav soli, temperatura, prisustvo drugih organskih supstanci koje mogu stupiti u interakciju sa proteinom). Veličina naboja proteinskih molekula je jedan od faktora koji utiču na njihovu rastvorljivost. Sa gubitkom naboja na izoelektričnoj tački, proteini se lakše agregiraju i talože. Ovo posebno vrijedi za denaturirane proteine, koji na svojoj površini imaju hidrofobne radikale aminokiselina.
Na površini proteinske molekule nalaze se pozitivno i negativno nabijeni radikali aminokiselina. Broj ovih grupa, a time i ukupni naboj proteina, zavisi od pH sredine, tj. omjer koncentracije H + - i OH - -grupa. U kiseloj sredini povećanje koncentracije H + dovodi do supresije disocijacije karboksilnih grupa -COO - + H +> - COOH i smanjenja negativnog naboja proteina. U alkalnom mediju, vezivanje viška OH - od strane protona nastalih pri disocijaciji amino grupa -NH 3 + + OH - - NH 2 + H 2 O sa stvaranjem vode dovodi do smanjenja pozitivnog naboja proteina. Naziva se pH vrijednost pri kojoj protein ima ukupan nulti naboj izoelektrična tačka (IEP). U IEP-u je isti broj pozitivno i negativno nabijenih grupa, tj. protein je u izoelektričnom stanju.
3. Odvajanje pojedinačnih proteina. Osobine strukture i funkcioniranja tijela zavise od skupa proteina koji se sintetiziraju u njemu. Proučavanje strukture i svojstava proteina nemoguće je bez njihove izolacije iz ćelije i pročišćavanja od drugih proteina i organskih molekula. Faze izolacije i pročišćavanja pojedinačnih proteina:
Uništavanje ćelija ispitivanog tkiva i dobijanje homogenata.
Odvajanje homogenata na frakcije centrifugiranjem, dobivanjem nuklearne, mitohondrijalne, citosolne ili druge frakcije koja sadrži željeni protein.
Selektivna toplotna denaturacija- kratkotrajno zagrijavanje proteinske otopine, pri čemu je moguće ukloniti dio denaturiranih proteinskih nečistoća (u slučaju da je protein relativno termostabilan).
Salting out. Različiti proteini precipitiraju pri različitim koncentracijama soli u otopini. Postepenim povećanjem koncentracije soli moguće je dobiti veći broj pojedinačnih frakcija sa dominantnim sadržajem izlučenog proteina u jednoj od njih. Amonijum sulfat se najčešće koristi za frakcionisanje proteina. Proteini sa najnižom rastvorljivošću talože se pri niskim koncentracijama soli.
Gel filtracija- metoda prosijavanja molekula kroz nabubrele granule sefadeksa (trodimenzionalni polisaharidni dekstran lanci sa porama). Brzina prolaska proteina kroz kolonu ispunjenu Sephadexom ovisit će o njihovoj molekularnoj težini: što je manja masa proteinskih molekula, to lakše prodiru u granule i ostaju tamo duže, što je veća masa, to brže eluiraju iz kolona.
Ultracentrifugiranje- metoda u kojoj se proteini u epruveti za centrifugu stavljaju u rotor ultracentrifuge. Kada se rotor rotira, brzina sedimentacije proteina je proporcionalna njihovoj molekularnoj težini: frakcije težih proteina nalaze se bliže dnu epruvete, lakši su bliže površini.
Elektroforeza- metoda zasnovana na razlikama u brzini kretanja proteina u električnom polju. Ova vrijednost je proporcionalna naboju proteina. Elektroforeza proteina se izvodi na papiru (u ovom slučaju brzina kretanja proteina je proporcionalna samo njihovom naboju) ili u poliakrilamidnom gelu sa određenom veličinom pora (brzina kretanja proteina je proporcionalna njihovom naboju i molekulskoj težini) .
Ionska izmjenjivačka hromatografija- metoda frakcionisanja zasnovana na vezivanju jonizovanih grupa proteina sa suprotno nabijenim grupama jonoizmenjivačkih smola (nerastvorljivi polimerni materijali). Snaga vezivanja proteina za smolu proporcionalna je naboju proteina. Proteini adsorbovani na polimeru sa ionskom izmenom mogu se isprati rastvorima NaCl sa povećanjem koncentracija; što je manji naboj proteina, to će biti potrebna niža koncentracija NaCl da bi se isprao protein vezan za jonske grupe smole.
Afinitetna hromatografija- najspecifičnija metoda za izolaciju pojedinačnih proteina.Ligand proteina je kovalentno vezan za inertni polimer. Kada se rastvor proteina propušta kroz kolonu sa polimerom zbog komplementarnog vezivanja proteina za ligand, na koloni se adsorbuje samo protein specifičan za dati ligand.
Dijaliza- metoda koja se koristi za uklanjanje jedinjenja male molekularne težine iz rastvora izolovanog proteina. Metoda se zasniva na nemogućnosti proteina da prođu kroz polupropusnu membranu, za razliku od supstanci male molekularne težine. Koristi se za pročišćavanje proteina od nečistoća male molekularne težine, na primjer, od soli nakon soljenja.
CILJEVI RADA VAN REVIZIJE
1. Popunite tabelu. 1.4.
Tabela 1.4. Komparativna analiza strukture i funkcija srodnih proteina - mioglobina i hemoglobina
a) zapamtite strukturu aktivnog centra MB i Hb. Koja je uloga hidrofobnih aminokiselinskih radikala u formiranju aktivnih centara ovih proteina? Opisati strukturu aktivnog centra MB i Hb i mehanizme vezivanja liganda za njega. Koja je uloga His F 8 i His E 7 ostataka u funkcionisanju MB i Hv aktivnog centra?
b) koja nova svojstva, u poređenju sa monomernim mioglobinom, ima blisko srodni oligomerni protein, hemoglobin? Objasniti ulogu kooperativnih promjena u konformaciji protomera u molekuli hemoglobina, utjecaj koncentracija CO2 i protona na afinitet hemoglobina prema kisiku, kao i ulogu 2,3-BPH u alosteričnoj regulaciji Hb funkcije.
2. Okarakterizirajte molekularne pratioce, obraćajući pažnju na odnos između njihove strukture i funkcije.
3. Koji su proteini grupisani u porodice? Koristeći porodicu imunoglobulina kao primjer, odredite slične strukturne karakteristike i srodne funkcije proteina ove porodice.
4. Pročišćeni pojedinačni proteini su često potrebni u biohemijske i medicinske svrhe. Objasniti za koja fizičko-hemijska svojstva proteina se koriste metode njihovog odvajanja i prečišćavanja.
ZADACI ZA SAMOKONTROLU
1. Odaberite tačne odgovore.
Funkcije hemoglobina:
A. Transport O2 iz pluća u tkiva B. Transport H+ iz tkiva u pluća
B. Održavanje konstantnog pH krvi D. Transport CO 2 iz pluća u tkivo
E. Transport CO 2 iz tkiva u pluća
2. Odaberite tačne odgovore. Ligandα -protomer HB je: A. Heme
B. Kiseonik
B. CO G. 2,3-BFG
E. β-protomer
3. Odaberite tačne odgovore.
Hemoglobin za razliku od mioglobina:
A. Ima kvartarnu strukturu
B. Sekundarna struktura je predstavljena samo α-helikama
B. Odnosi se na kompleksne proteine
D. Interagira sa alosteričnim ligandom D. Kovalentno vezan za hem
4. Odaberite tačne odgovore.
Afinitet Nv prema O 2 opada:
A. Sa dodatkom jednog O 2 molekula B. Uz eliminaciju jednog O 2 molekula
B. Kod interakcije sa 2,3-BFG
D. Kada se veže na protomere H + D. Sa smanjenjem koncentracije 2,3-BFG
5. Uspostavite korespondenciju.
Tipično za HB tipove:
A. U deoksi obliku formira fibrilarne agregate B. Sadrži dva α- i dva δ-lanca
B. Preovlađujući oblik HB u eritrocitima odrasle osobe D. U aktivnom centru sadrži hem sa Fe + 3
E. Sadrži dva α- i dva γ-lanca 1. NvA 2.
6. Uspostavite korespondenciju.
Ligandi HB:
A. Veže se za HB u alosteričnom centru
B. Ima vrlo visok afinitet prema aktivnom centru HB
B. Spajanje, povećava afinitet Hb za O 2 G. Oksidira Fe + 2 u Fe + 3
E. Formira kovalentnu vezu sa svojim F8
7. Odaberite tačne odgovore.
pratioci:
A. Proteini prisutni u svim dijelovima ćelije
B. Sinteza je pojačana stresom
B. Učestvuje u hidrolizi denaturiranih proteina
D. Učestvuje u održavanju prirodne konformacije proteina
E. Stvoriti organele u kojima se formira proteinska konformacija
8. Podesite korespondenciju. imunoglobulini:
A. Sekretorni oblik je pentameričan
B. Klasa Ig, prodire kroz placentnu barijeru
B. Ig - receptor mastocita
D. Glavna klasa Ig, prisutna u sekretima epitelnih ćelija. E. B-limfocitni receptor, čija aktivacija osigurava proliferaciju ćelija
9. Odaberite tačne odgovore.
Imunoglobulini E:
A. Proizvode makrofagi B. Imaju teške ε-lance.
B. Ugrađeni su u membranu T-limfocita
D. Igraju ulogu membranskih receptora za antigene na mastocitima i bazofilima
E. Odgovoran za ispoljavanje alergijskih reakcija
10. Odaberite tačne odgovore.
Metoda odvajanja proteina zasniva se na razlikama u njihovoj molekularnoj težini:
A. Gel filtracija
B. Ultracentrifugiranje
B. Elektroforeza na poliakrilamidnom gelu D. Jonska izmjenjivačka hromatografija
D. Afinitetna hromatografija
11. Izaberi tačan odgovor.
Metoda odvajanja proteina zasniva se na razlikama u njihovoj rastvorljivosti u vodi:
A. Gel filtracija B. Soljenje
B. Hromatografija jonske izmjene D. Afinitetna hromatografija
D. Elektroforeza u poliakrilamidnom gelu
STANDARDI ODGOVORA NA "ZADACI ZA SAMOKONTROLU"
1.A, B, C, D
2.A, B, C, D
5.1-B, 2-A, 3-D
6.1-B, 2-B, 3-A
7.A, B, D, D
8.1-D; 2-B, 3-C
OSNOVNI POJMOVI I POJMOVI
1. Oligomerni proteini, protomere, kvarterna struktura proteina
2. Kooperativne promjene u konformaciji protomera
3. Borov efekat
4. Alosterična regulacija proteinskih funkcija, alosterični centar i alosterični efektor
5. Molekularni pratioci, proteini toplotnog šoka
6. Porodice proteina (serinske proteaze, imunoglobulini)
7. IgM-, G-, E-, A-veza strukture sa funkcijom
8. Ukupan naboj proteina, izoelektrična tačka proteina
9. Elektroforeza
10. Soljenje
11. Gel filtracija
12. Hromatografija jonske izmjene
13. Ultracentrifugiranje
14. Afinitetna hromatografija
15. Elektroforeza proteina krvne plazme
ZADACI ZA REVIZORSKI RAD
1. Uporedite zavisnosti stepena zasićenosti hemoglobina (Hb) i mioglobina (Mb) kiseonikom o njegovom parcijalnom pritisku u tkivima
 Rice. 1.34. Zavisnost od zasićenja Mv iHbkiseonik iz njegovog parcijalnog pritiska
Rice. 1.34. Zavisnost od zasićenja Mv iHbkiseonik iz njegovog parcijalnog pritiska
Imajte na umu da je oblik krivulja zasićenja kisikom za proteine različit: za mioglobin - hiperbola, za hemoglobin - sigmoidni oblik.
1.Uporedite vrijednosti parcijalnog tlaka kisika, pri kojem su MB i HB zasićeni O 2 za 50%. Koji od ovih proteina ima veći afinitet za O2?
2. Koje strukturne karakteristike MB određuju njegov visok afinitet za O 2?
3. Koje strukturne karakteristike HB mu omogućavaju da ispušta O 2 u kapilare tkiva u mirovanju (pri relativno visokom parcijalnom pritisku od O 2) i naglo povećava ovaj povratak u radnim mišićima? Koja osobina oligomernih proteina daje ovaj efekat?
4.Izračunajte koja količina O2 (u%) daje oksigenirani hemoglobin mišićima koji se odmaraju i rade?
5. izvući zaključke o odnosu između strukture proteina i njegove funkcije.
2. Količina kiseonika koju hemoglobin oslobađa u kapilarama zavisi od intenziteta kataboličkih procesa u tkivima (Bohrov efekat). Kako promjene u metabolizmu tkiva regulišu afinitet Hb prema O 2? Utjecaj CO 2 i H + na afinitet Hb za O 2
 1. Opišite Bohrov efekat.
1. Opišite Bohrov efekat.
2. u kom pravcu je proces prikazan na dijagramu:
a) u kapilarama pluća;
b) u tkivnim kapilarama?
3. Koji je fiziološki značaj Bohrovog efekta?
4. Zašto interakcija Hb sa H+ na mjestima udaljenim od hema mijenja afinitet proteina za O 2?
3. Afinitet Hb prema O 2 ovisi o koncentraciji njegovog liganda, 2,3-bisfosfoglicerata, koji je alosterički regulator afiniteta Hb prema O 2. Zašto interakcija liganda na mjestu udaljenom od aktivnog mjesta utječe na funkciju proteina? Kako 2,3-BFG reguliše afinitet Hb prema O 2? Da biste riješili problem, odgovorite na sljedeća pitanja:
1.Gdje i iz čega se sintetiše 2,3-bisfosfoglicerat (2,3-BFG)? Zapišite njegovu formulu, označite naboj datog molekula.
2. S kojim oblikom hemoglobina (oksi ili deoksi) BFH stupa u interakciju i zašto? U kom dijelu HB molekula dolazi do interakcije?
3. u kom pravcu je proces prikazan na dijagramu
a) u tkivnim kapilarama;
b) u kapilarama pluća?
4.gdje bi koncentracija kompleksa trebala biti veća
NV-2,3-BFG:
a) u kapilarama mišića u mirovanju,
b) u kapilarama mišića koji rade (pod pretpostavkom iste koncentracije BFG u eritrocitima)?
5. Kako će se promijeniti afinitet Hb prema kiseoniku kada se osoba prilagodi visinskim uslovima, ako se poveća koncentracija BFG u eritrocitima? Koji je fiziološki značaj ovog fenomena?
4. Uništavanje 2,3-BFG tokom skladištenja krvi u konzervi narušava funkciju HB. Kako će se promijeniti afinitet Hb prema O 2 u očuvanoj krvi ako se koncentracija 2,3-BFG u eritrocitima može smanjiti sa 8 na 0,5 mmol/l. Je li moguće transfuzirati takvu krv kritično bolesnim pacijentima ako se koncentracija 2,3-BFG vrati najkasnije tri dana kasnije? Da li je moguće vratiti funkciju eritrocita dodavanjem 2,3-BFG u krv?
5. Zapamtite strukturu najjednostavnijih molekula imunoglobulina. Kakvu ulogu imaju imunoglobulini u imunološkom sistemu? Zašto se Ig često naziva bivalentnim? Kako je struktura Ig povezana s njihovom funkcijom? (Opišite primjer klase imunoglobulina.)
Fizičko-hemijska svojstva proteina i metode njihovog odvajanja.
6. Kako neto naboj proteina utiče na njegovu rastvorljivost?
a) odrediti ukupni naboj peptida pri pH 7
Ala-Glu-Tre-Pro-Asp-Liz-Cis
b) kako će se promijeniti naboj ovog peptida pri pH> 7, pH<7, рН <<7?
c) koja je izoelektrična tačka proteina (IEP) i u kojoj sredini leži
IEP ovog peptida?
d) pri kojoj pH vrijednosti će se primijetiti najmanja rastvorljivost ovog peptida.
7. Zašto se kiselo mlijeko, za razliku od svježeg mlijeka, „sgruša“ pri ključanju (tj. kazein mlječni protein precipitira)? U svježem mlijeku molekuli kazeina imaju negativan naboj.
8. Metoda gel filtracije koristi se za odvajanje pojedinačnih proteina. Smjesa koja sadrži proteine A, B, C sa molekularnom težinom od 160.000, 80.000, odnosno 60.000, analizirana je gel filtracijom (slika 1.35). Nabubrele granule gela su propusne za proteine sa molekulskom težinom manjom od 70 000. Koji je princip iza ove metode odvajanja? Koji graf ispravno predstavlja rezultate frakcioniranja? Odredite redosled kojim proteini A, B i C izlaze iz kolone.
 Rice. 1.35. Korištenje metode gel filtracije za odvajanje proteina
Rice. 1.35. Korištenje metode gel filtracije za odvajanje proteina
9. Na sl. 1.36, A prikazuje dijagram elektroforeze na papiru proteina krvnog seruma zdrave osobe. Relativne količine proteinskih frakcija dobijenih ovom metodom su: albumini 54-58%, α1-globulini 6-7%, α2-globulini 8-9%, β-globulini 13%, γ-globulini 11-12% . ..
 Rice. 1.36 Elektroforeza na papiru proteina krvne plazme zdrave osobe (A) i pacijenta (B)
Rice. 1.36 Elektroforeza na papiru proteina krvne plazme zdrave osobe (A) i pacijenta (B)
I - γ-globulini; II - β-globulini; III -α 2 -globulin; IV -α 2 -globulin; V - albumin
Mnoge bolesti su praćene kvantitativnim promjenama u sastavu serumskih proteina (disproteinemija). Priroda ovih promjena uzima se u obzir prilikom postavljanja dijagnoze i procjene težine i stadijuma bolesti.
Koristeći podatke date u tabeli. 1.5, dajte pretpostavku o bolesti koju karakteriše elektroforetski profil prikazan na Sl. 1.36.
Tabela 1.5. Promjene u koncentraciji serumskih proteina u patologiji
Ppt% 5C34928-slozhnye_belki_ch1_1.jpg "alt =" (! LANG:> Aktivni centar proteina i njegova interakcija sa ligandom. Tokom formiranja tercijarne strukture"> Активный центр белка и его взаимодействие с лигандом. В процессе формирования третичной структуры на поверхности функционально активного белка, обычно в углублении, образуется участок, сформированный радикалами аминокислот, далеко стоящими друг от друга в первичной структуре. Этот участок, имеющий уникальное строение для данного белка и способный специфично взаимодействовать с определенной молекулой или группой похожих молекул, называется центром связывания белка с лигандом или активным центром. Лигандами называются молекулы, взаимодействующие с белками.!}
Ppt% 5C34928-slozhnye_belki_ch1_2.jpg "alt =" (! LANG:> Ligand može biti supstanca niske molekulske težine ili visoke molekulske težine (makromolekula), uključujući"> Лигандом может быть как низкомолекулярное, так и высокомолекулярное (макромолекула) вещество, в том числе и другой белок. Лигандами являются субстраты ферментов, кофакторы, ингибиторы и активаторы ферментов, протомеры в олигомерном белке и т.д.!}
Ppt% 5C34928-slozhnye_belki_ch1_3.jpg "alt =" (! LANG:> Visoka specifičnost interakcije proteina sa ligandom je obezbeđena komplementarnošću strukture aktivnog centra sa strukturom liganda.">!}
Ppt% 5C34928-slozhnye_belki_ch1_4.jpg "alt =" (! LANG:> Komplementarnost je prostorna i hemijska korespondencija površina u interakciji. Aktivno mjesto ne treba samo"> Комплементарность - это пространственное и химическое соответствие взаимодействующих поверхностей. Активный центр должен не только пространственно соответствовать входящему в него лиганду, но и между функциональными группами радикалов, входящих в активный центр, и лигандом должны образоваться связи чаще всего нековалентные (ионные, водородные, а также гидрофобные взаимодействия), которые удерживают лиганд в активном центре.!}
Ppt% 5C34928-slozhnye_belki_ch1_5.jpg "alt =" (! LANG:> Komplementarna interakcija protein-ligand">!}
Ppt% 5C34928-slozhnye_belki_ch1_6.jpg "alt ="> ">
Ppt% 5C34928-slozhnye_belki_ch1_7.jpg "alt ="> ">
Ppt% 5C34928-slozhnye_belki_ch1_8.jpg "alt =" (! LANG:> KLASIFIKACIJA PROTEINA 1. Jednostavni proteini se sastoje samo od aminokiselina. 2. Složeni proteini (holoproteini)"> КЛАССИФИКАЦИЯ БЕЛКОВ 1. Простые белки состоят только из аминокислот. 2. Сложные белки (холопротеины) содержат белковую часть (апопротеин) и небелковую (простетическую) группу.!}
Ppt% 5C34928-slozhnye_belki_ch1_9.jpg "alt =" (! LANG:> Različite organske (lipidi, ugljeni hidrati) i neorganske (metali) supstance mogu delovati kao protetička grupa."> В качестве простетической группы могут выступать различные органические (липиды, углеводы) и неорганические (металлы) вещества. Связь между простетической группой и апопротеином может быть как ковалентная, так и нековалентная. Простетическую группу порой можно рассматривать в качестве лиганда. Наличие небелковой части обеспечивает выполнение белком его функции. При утрате простетической группы холопротеин теряет свою активность.!}
Ppt% 5C34928-slozhnye_belki_ch1_10.jpg "alt =" (! LANG:> Kompleksni proteini - hromoproteini - nukleoproteini - lipoproteini - fosfoproteini - glikoproteini - metaloproteini">!}
Ppt% 5C34928-slozhnye_belki_ch1_11.jpg "alt =" (! LANG:> Metaloproteini uključuju holoenzime koji sadrže ne-hem koordinirane metalne jone."> Металлопротеинам можно отнести холоферменты, содержащие негемовые координационно связанные ионы металлов. Среди металлопротеинов есть белки, выполняющие депонирующие и транспортные функции (например, железосодержащие ферритин и трансферрин) и ферменты (например, цинксодержащая карбоангидраза и различные супероксиддисмутазы, содержащие в качестве активных центров ионы меди, марганца, железа и других металлов). Но и хромопротеины, содержащие ионы металлов, также можно отнести к металлопротеинам.!}
Ppt% 5C34928-slozhnye_belki_ch1_12.jpg "alt =" (! LANG:> Metaloproteini su često enzimi. Metalni joni u ovom slučaju: - učestvuju u orijentaciji supstrata"> Металлопротеины часто являются ферментами. Ионы металлов в этом случае: - участвуют в ориентации субстрата в активном центре фермента, входят в состав активного центра фермента и участвуют в катализе, являясь, например, акцепторами электронов на определенной стадии ферментативной реакции. Часто ион металла в составе фермента называют кофактором.!}
Ppt% 5C34928-slozhnye_belki_ch1_13.jpg "alt =" (! LANG:> Enzimski metaloproteini uključuju proteine koji sadrže, na primjer: - bakar - citokrom oksidazu, u kompleksu"> К ферментативным металлопротеинам относятся белки, содержащие например: - медь – цитохромоксидаза, в комплексе с другими ферментами дыхательной цепи митохондрий участвует в синтезе АТФ, - железо – ферритин, депонирующий железо в клетке, трансферрин, переносящий железо в крови, каталаза, обезвреживающая перекись водорода, - цинк – алкогольдегидрогеназа, обеспечивающая метаболизм этанола и других спиртов, лактатдегидрогеназа, участвующая в метаболизме молочной кислоты, - карбоангидраза, образующая угольную кислоту из CO2 и H2O, - щелочная фосфатаза, гидролизующая фосфорные эфиры различных соединений, - α2-макроглобулин, антипротеазный белок крови. - селен – тиреопероксидаза, участвующая в синтезе гормонов щитовидной железы, антиоксидантный фермент глутатионпероксидаза, - кальций – α-амилаза слюны и панкреатического сока, гидролизующая крахмал.!}
Ppt% 5C34928-slozhnye_belki_ch1_14.jpg "alt =" (! LANG:> Feritin">!}
Ppt% 5C34928-slozhnye_belki_ch1_15.jpg "alt =" (! LANG:> Fosfoproteini su proteini u kojima je prisutna fosfatna grupa. Veže se za peptidni lanac"> Фосфопротеины – это белки, в которых присутствует фосфатная группа. Она связывается с пептидной цепью через остатки тирозина, серина и треонина, т.е. тех аминокислот, которые содержат ОН-группу. Способ присоединения фосфата к белку на примере серина и тирозина!}
Ppt% 5C34928-slozhnye_belki_ch1_16.jpg "alt =" (! LANG:> Fosforna kiselina može obavljati: - Strukturnu ulogu, dajući naboj, rastvorljivost i mijenja svojstva"> Фосфорная кислота может выполнять: - Структурную роль, придавая заряд, растворимость и изменяя свойства белка, например, в казеине молока, яичном альбумине. Наличие остатков фосфорной кислоты способствует связыванию кальция, что необходимо для формирования, например, костной ткани. - Функциональную роль. В клетке присутствует много белков, которые связаны с фосфатом не постоянно, а в зависимости от активности метаболизма. Белок может многократно переходить в фосфорилированную или в дефосфорилированную форму, что играет регулирующую роль в его работе.!}
Ppt% 5C34928-slozhnye_belki_ch1_17.jpg "alt =" (! LANG:> Fosforilacija je proces prenošenja ostatka fosforne kiseline iz fosforilirajućeg donora na supstrat, obično"> Фосфорилирование - процесс переноса остатка фосфорной кислоты от фосфорилирующего агента-донора к субстрату, как правило, катализируемый ферментами (киназами) и ведущий к образованию эфиров фосфорной кислоты. Дефосфорилирование (утрату остатка фосфорной кислоты) катализируют фосфатазы. АТФ + R-OH → АДФ + R-OPO3H2 R-OPO3H2 + Н2О → R-OH + Н3РО4!}
Ppt% 5C34928-slozhnye_belki_ch1_18.jpg "alt =" (! LANG:> Primjeri: 1) enzimi glikogen sintaze i glikogen fosforilaze 2) fosforilirani histoni se slabije vezuju"> Примеры: 1) ферменты гликогенсинтаза и гликогенфосфорилаза 2) гистоны в фосфорилированном состоянии менее прочно связываются с ДНК и активность генома возрастает. Изменение конформации белка в фосфорилированном и дефосфорилированном состоянии!}
Ppt% 5C34928-slozhnye_belki_ch1_19.jpg "alt =" (! LANG:> Lipoproteini sadrže nekovalentno vezane lipide kao protetski dio. Lipidi, posebno"> Липопротеины содержат в качестве простетической части нековалентно связанные липиды. Липиды, в частности жиры, холестерол и его эфиры не растворяются в водных фазах организма, поэтому транспорт их кровью и лимфой осуществляется в виде комплексов с белками и фосфолипидами, которые называются липопротеинами.!}
Ppt% 5C34928-slozhnye_belki_ch1_20.jpg "alt =" (! LANG:> Svi lipoproteini imaju sličnu strukturu: jezgro se sastoji od hidrofobnih molekula: triacilglicerola, estera holesterola i"> Все липопротеины имеют сходное строение: ядро состоит из гидрофобных молекул: триацилглицеролов, эфиров холестерола, а на поверхности находится монослой фосфолипидов, полярные группы которых обращены к воде, а гидрофобные погружены в гидрофобное ядро липопротеина. Кроме фосфолипидов, на поверхности находятся белки – аполипопротеины (апобелками). Их выделяют несколько видов: А, В, С, D. В каждом типе липопротеинов преобладают соответствующие ему апобелки. Аполипопротеины выполняют различные функции. Интегральные аполипопротеины являются структурными компонентами. Периферические аполипопротеины в плазме крови могут передаваться от одного типа липопротеинов к другим, определяя их дальнейшие превращения.!}
Ppt% 5C34928-slozhnye_belki_ch1_21.jpg "alt =" (! LANG:> Dijagram strukture lipoproteina Struktura lipoproteina">!}
Ppt% 5C34928-slozhnye_belki_ch1_22.jpg "alt =" (! LANG:> Struktura lipoproteina krvne plazme">!}
Ppt% 5C34928-slozhnye_belki_ch1_23.jpg "alt =" (! LANG:> Postoje četiri glavne klase lipoproteina: - lipoproteini visoke gustine (HDL), - lipoproteini niske gustine (LDL),"> Выделяют четыре основных класса липопротеинов: -липопротеины высокой плотности (ЛПВП), -липопротеины низкой плотности (ЛПНП), -липопротеины очень низкой плотности (ЛПОНП), -хиломикроны (ХМ). Каждый из типов ЛП образуется в разных тканях и транспортирует определённые липиды. Концентрация и соотношение в крови тех или иных липопротеинов играют ведущую роль в возникновении такой распространенной сосудистой патологии как атеросклероз. ЛПВП являются антиатерогенными, ЛПНП и ЛПОНП – атерогенными.!}
Ppt% 5C34928-slozhnye_belki_ch1_24.jpg "alt ="> ">
Ppt% 5C34928-slozhnye_belki_ch1_25.jpg "alt =" (! LANG:> Glikoproteini ili glikokonjugati su proteini koji sadrže komponentu ugljikohidrata kovalentno vezanu za polipeptidnu bazu."> Гликопротеины или, гликоконъюгаты – это белки, содержащие углеводный компонент, ковалентно присоединенный к полипептидной основе. Содержание углеводов в них варьирует от 1% до 98% по массе. Два подкласса белков, содержащих углеводы: ■ протеогликаны ■ гликопротеины!}
Opis = "">
Ppt% 5C34928-slozhnye_belki_ch1_27.jpg "alt =" (! LANG:> Glikoproteine karakteriše nizak sadržaj ugljenih hidrata, koji su vezani: - N-glikozidnom vezom za NH2-grupu nekih"> Для гликопротеинов характерно невысокое содержание углеводов, которые присоединены: - N-гликозидной связью к NН2-группе какого-нибудь аминокислотного остатка, например, аспарагина; - О-гликозидной связью к гидроксильной группе остатка серина, треонина,тирозина, гидроксилизина.!}
Ppt% 5C34928-slozhnye_belki_ch1_28.jpg "alt =" (! LANG:> Formiranje O- i N-glikozidnih veza u glikoproteinima. 1 - N-glikozidna veza između amidne grupe"> Образование О- и N-гликозидных связей в гликопротеинах. 1 - N-гликозидная связь между амидной группой аспарагина и ОН-группой моносахарида; 2 - О-гликозидная связь между ОН-группой серина и ОН-группой моносахарида.!}
Ppt% 5C34928-slozhnye_belki_ch1_29.jpg "alt =" (! LANG:> Metoda vezivanja ugljikohidrata za proteine">!}
Ppt% 5C34928-slozhnye_belki_ch1_30.jpg "alt =" (! LANG:> Funkcije glikoproteina su: 1. Strukturne - bakterijski ćelijski zid, koštani matriks, npr. kolagen, elastin."> Функцией гликопротеинов являются: 1. Структурная – клеточная стенка бактерий, костный матрикс, например, коллаген, эластин. 2. Защитная – например, антитела, интерферон, факторы свертывания крови (протромбин, фибриноген). 3. Рецепторная – присоединение эффектора приводит к изменению конформации белка-рецептора, что вызывает внутриклеточный ответ. 4. Гормональная – гонадотропный, адренокортикотропный и тиреотропный гормоны. 5. Ферментативная – холинэстераза, нуклеаза. 6. Транспортная – перенос веществ в крови и через мембраны, например, трансферрин, транскортин, альбумин, Na+,К+-АТФаза.!}
Ppt% 5C34928-slozhnye_belki_ch1_31.jpg "alt =" (! LANG:> Dijagram strukture proteinskog receptora">!}
Ppt% 5C34928-slozhnye_belki_ch1_32.jpg "alt =" (! LANG:> Hromoproteini su skupni naziv za kompleksne proteine sa obojenim prostetičkim grupama različite hemijske prirode."> Хромопротеины - собирательное название сложных белков с окрашенными простетическими группами различной химической природы. гемопротеины (содержат гем), ретинальпротеины (содержат витамин А), флавопротеины (содержат витамин В2), кобамидпротеины (содержат витамин В12).!}
Ppt% 5C34928-slozhnye_belki_ch1_33.jpg "alt =" (! LANG:> Flavoproteini su enzimi redoks reakcija. Sadrže derivate vitamina B2 flavin mononukleotida (FMN) i flavin adenin dinukleotida"> Флавопротеины - это ферменты окислительно-восстановительных реакций. Содержат производные витамина В2 флавинмононуклеотид (ФМН) и флавинадениндинуклеотид (ФАД). Связываются данные простетические группы ковалентно и придают желтое окрашивание. Эти простетические группы являются производными изоаллоксазина.!}
Ppt% 5C34928-slozhnye_belki_ch1_34.jpg "alt =" (! LANG:> Izoaloksazin je heterociklično jedinjenje izvedeno iz pteridina. Molekula izoaloksazina se sastoji od tri aromatična prstena -"> Изоаллоксазин - гетероциклическое соединения, производное птеридина. Молекула изоаллоксазина состоит из трех ароматических колец - бензольного, пиримидинового, пиразинового.!}
Ppt% 5C34928-slozhnye_belki_ch1_35.jpg "alt =" (! LANG:> Hromoproteini koji sadrže hem. Strukturno slični porfirini željeza ili magnezija uključeni su kao neproteinska komponenta."> Гемопротеины - гем-содержащие хромопротеины. В качестве небелкового компонента включают структурно сходные железо- или магнийпорфирины. Белковый компонент может быть разнообразным как по составу, так и по структуре. Основу структуры простетической группы большинства гемосодержащих белков составляет порфириновое кольцо, являющееся в свою очередь производным тетрапиррольного соединения – порфирина. Порфирин!}
Ppt% 5C34928-slozhnye_belki_ch1_36.jpg "alt =" (! LANG:> Porfirinski prsten je sposoban da formira koordinaciona jedinjenja sa raznim metalnim jonima."> Порфириновое кольцо способно образовывать координационные соединения с различными ионами металлов. В результате комплексообразования формируются металлопорфирины: содержащие ионы железа – гемоглобины, миоглобин, цитохромы, пероксидаза, каталаза и др. (красное окрашивание), содержщие ионы магния – хлорофилл (зеленое окрашивание). Витамин В12 (кобалимин) содержит координированный ион кобальта Со2+ в порфириноподобном макроцикле – коррине, состоящем из четырех частично гидрированных пиррольных колец (розовое окрашивание).!}
Ppt% 5C34928-slozhnye_belki_ch1_37.jpg "alt =" (! LANG:> Hlorofil b. Hlorofili su uključeni u fotosintezu.">!}
Ppt% 5C34928-slozhnye_belki_ch1_38.jpg "alt =" (! LANG:> Citohromi se razlikuju po sastavu aminokiselina peptidnih lanaca, broju lanaca i dijele se na tipove a, b,"> Цитохромы различаются аминокислотным составом пептидных цепей, числом цепей и разделяются на типы а, b, с, d. Цитохромы находятся в составе дыхательной цепи и цепи микросомального окисления. Степень окисления железа в составе цитохромов меняется в отличие от гемоглобина и миоглобина Fe2+ ↔ Fe3+!}
Ppt% 5C34928-slozhnye_belki_ch1_39.jpg "alt =" (! LANG:> Mioglobin (MB) je protein koji se nalazi u crvenim mišićima čija je glavna funkcija skladištenje"> Миоглобин (Мв) - белок, находящийся в красных мышцах, основная функция которого - создание запасов О2, необходимых при интенсивной мышечной работе. Мв - сложный белок, содержащий белковую часть - апоМв и небелковую часть - гем. Первичная структура апоМв определяет его компактную глобулярную конформацию и структуру активного центра, к которому присоединяется небелковая часть миоглобина - гем. Кислород, поступающий из крови в мышцы, связывается с Fe2+ гема в составе миоглобина. Мв - мономерный белок, имеющий очень высокое сродство к О2, поэтому отдача кислорода миоглобином происходит только при интенсивной мышечной работе, когда парциальное давление O2 резко снижается. Формирование пространственных структур и функционирование миоглобина.!}
Ppt% 5C34928-slozhnye_belki_ch1_40.jpg "alt =" (! LANG:> Formiranje MB konformacije."> Формирование конформации Мв. В красных мышцах на рибосомах в ходе трансляции идет синтез первичной структуры Мв, представленной специфической последовательностью 153 аминокислотных остатков. Вторичная структура Мв содержит восемь α-спиралей, называемых латинскими буквами от А до Н, между которыми имеются неспирализованные участки. Третичная структура Мв имеет вид компактной глобулы, в углублении которой между F и Е α-спиралями расположен активный центр.!}
Ppt% 5C34928-slozhnye_belki_ch1_41.jpg "alt =" (! LANG:> Struktura mioglobina">!}
Ppt% 5C34928-slozhnye_belki_ch1_42.jpg "alt =" (! LANG:> Karakteristike strukture i funkcionisanja MB aktivnog centra. MB aktivni centar formiraju uglavnom hidrofobni radikali"> Особенности строения и функционирования активного центра Мв. Активный центр Мв сформирован преимущественно гидрофобными радикалами аминокислот, далеко отстоящими друг от друга в первичной структуре (например, Три39 и Фен138). К активному центру присоединяется плохо растворимые в воде лиганды - гем и О2. Гем - специфический лиганд апоМв.!}
Ppt% 5C34928-slozhnye_belki_ch1_43.jpg "alt =" (! LANG:> Hem se zasniva na četiri pirolna prstena povezana methenilnim mostovima; atom Fe2 + se nalazi u centru,"> Основу гема составляют четыре пиррольных кольца, соединенных метенильными мостиками; в центре расположен атом Fe2+, соединенный с атомами азота пиррольных колец четырьмя координационными связями. В активном центре Мв кроме гидрофобных радикалов аминокислот имеются также остатки двух аминокислот с гидрофильными радикалами - Гис Е7 (Гис64) и Гис F8 (Гис93).!}
Ppt% 5C34928-slozhnye_belki_ch1_44.jpg "alt =" (! LANG:> Njegov F8 formira koordinacionu vezu sa Fe2+ i čvrsto fiksira hem u aktivnom centru."> Гис F8 образует координационную связь с Fe2+ и прочно фиксирует гем в активном центре. Гис Е7 необходим для правильной ориентации в активном центре другого лиганда - O2 при его взаимодействии с Fe+2 гема. Микроокружение гема создает условия для прочного, но обратимого связывания O2 с Fe+2 и препятствует попаданию в гидрофобный активный центр воды, что может привести к его окислению в Fе3+.!}
Ppt% 5C34928-slozhnye_belki_ch1_45.jpg "alt =" (! LANG:> Oligomerna struktura HB i regulacija afiniteta HB na O2 ligande. Ljudski hemoglobini -"> Олигомерное строение Нв и регуляция сродства Нв к О2 лигандами. Гемоглобины человека - семейство белков, так же как и миоглобин относящиеся к сложным белкам (гемопротеинам). Они имеют тетрамерное строение и содержат две α-цепи, но различаются по строению двух других полипептидных цепей (2α-, 2х-цепи). Строение второй полипептидной цепи определяет особенности функционирования этих форм Нв. Около 98% гемоглобина эритроцитов взрослого человека составляет гемоглобин А (2α-, 2β-цепи). В период внутриутробного развития функционируют два основных типа гемоглобинов: эмбриональный Нв (2α, 2ε), который обнаруживается на ранних этапах развития плода, и гемоглобин F (фетальный) - (2α, 2γ), который приходит на смену раннему гемоглобину плода на шестом месяце внутриутробного развития и только после рождения замещается на Нв А.!}
Ppt% 5C34928-slozhnye_belki_ch1_46.jpg "alt =" (! LANG:> HB A je protein vezan za mioglobin (MB), koji se nalazi u eritrocitima odrasle osobe."> Нв А - белок, родственный миоглобину (Мв), содержится в эритроцитах взрослого человека. Строение его отдельных протомеров аналогично таковому у миоглобина. Вторичная и третичная структуры миоглобина и протомеров гемоглобина очень сходны, несмотря на то что в первичной структуре их полипептидных цепей идентичны только 24 аминокислотных остатка (вторичная структура протомеров гемоглобина, так же как миоглобин, содержит восемь α-спиралей, обозначаемых латинскими буквами от А до Н, а третичная структура имеет вид компактной глобулы). Но в отличие от миоглобина гемоглобин имеет олигомерное строение, состоит из четырех полипептидных цепей, соединенных нековалентными связями.!}
Ppt% 5C34928-slozhnye_belki_ch1_47.jpg "alt =" (! LANG:> Oligomerna struktura hemoglobina">!}
Ppt% 5C34928-slozhnye_belki_ch1_48.jpg "alt =" (! LANG:> Svaki HB protomer je povezan sa ne-proteinskim dijelom - hemom i susjednim protomerima."> Каждый протомер Нв связан с небелковой частью - гемом и соседними протомерами. Соединение белковой части Нв с гемом аналогично таковому у миоглобина: в активном центре белка гидрофобные части гема окружены гидрофобными радикалами аминокислот за исключением Гис F8 и Гис Е7, которые расположены по обе стороны от плоскости гема и играют аналогичную роль в функционировании белка и связывании его с кислородом. Кроме того, Гис Е7 выполняет важную дополнительную роль в функционировании Нв. Свободный гем имеет в 25 000 раз более высокое сродство к СО, чем к О2. СО в небольших количествах образуется в организме и, учитывая его высокое сродство к гему, он мог бы нарушать транспорт необходимого для жизни клеток О2. Однако в составе гемоглобина сродство гема к оксиду углерода превышает сродство к О2 всего в 200 раз благодаря наличию в активном центре Гис Е7. Остаток этой аминокислоты создает оптимальные условия для связывания гема с O2 и ослабляет взаимодействие гема с СО.!}
Ppt% 5C34928-slozhnye_belki_ch1_49.jpg "alt ="> ">
Ppt% 5C34928-slozhnye_belki_ch1_50.jpg "alt =" (! LANG:> Prstenovi hema pirola nalaze se u istoj ravni, a Fe2+ jon je u neoksigeniranom stanju Hb"> Пиррольные кольца гема расположены в одной плоскости, а ион Fe2+ в неоксигенированом состоянии Hb выступает над плоскостью на 0,6 А. При присоединении кислорода ион железа погружается в плоскость колец гема. В результате сдвигается и участок полипептидной цепи, нарушаются слабые связи в молекуле Hb и изменяется конформация всей глобулы. Таким образом, присоединение кислорода вызывает изменение пространственной структуры молекулы миоглобина или протомеров гемоглобина.!}
Ppt% 5C34928-slozhnye_belki_ch1_51.jpg "alt =" (! LANG:> Hemoglobin može postojati u slobodnom (deoksihemoglobin) i oksigeniranom obliku, vezujući se za"> Гемоглобин может существовать как в свободной (дезоксигемоглобин), так и в оксигенированной форме, присоединяя до 4 молекул кислорода. Взаимодействие с кислородом 1-го протомера вызывает изменение его конформации, а также кооперативные конформационные изменения остальных протомеров. Сродство к кислороду возрастает, и присоединение О2 к активному центру 2-го протомера происходит легче, вызывая дальнейшую конформационную перестройку всей молекулы. В результате еще сильнее изменяется структура оставшихся протомеров и их активных центров, взаимодействие с О2 еще больше облегчается. В итоге 4-я молекула кислорода присоединяется к Hb примерно в 300 раз легче, чем 1-я. Так происходит в легких при высоком парциальном давлении кислорода.!}
Ppt% 5C34928-slozhnye_belki_ch1_52.jpg "alt =" (! LANG:> Kooperativne promjene u konformaciji molekula hemoglobina nakon interakcije s kisikom">!}
Ppt% 5C34928-slozhnye_belki_ch1_53.jpg "alt =" (! LANG:> U tkivima gde je sadržaj kiseonika manji, naprotiv, cepanje svakog O2 molekula olakšava oslobađanje sledećih."> В тканях, где содержание кислорода ниже, наоборот, отщепление каждой молекулы О2 облегчает освобождение последующих. Таким образом, взаимодействие олигомерного белка гемоглобина с лигандом (О2) в одном центре связывания приводит к изменению конформации всей молекулы и других, пространственно удаленных центров, расположенных на других субъединицах (принцип «домино»). Подобные взаимосвязанные изменения структуры белка называют кооперативными конформационными изменениями. Они характерны для всех олигомерных белков и используются для регуляции их активности.!}
Ppt% 5C34928-slozhnye_belki_ch1_54.jpg "alt =" (! LANG:> Interakcija oba proteina (Mb i Hb) sa kiseonikom zavisi od njegovog parcijalnog pritiska u"> Взаимодействие обоих белков (Mb и Hb) с кислородом зависит от его парциального давления в тканях. Эта зависимость имеет разный характер, что связано с их особенностями структуры и функционирования. Гемоглобин имеет S-образную кривую насыщения, которая показывает, что субъединицы белка работают кооперативно, и чем больше кислорода они отдают, тем легче идет освобождение остальных молекул О2. Этот процесс зависит от изменения парциального давления кислорода в тканях. График насыщения миоглобина кислородом имеет характер простой гиперболы, т.е. насыщение Mb кислородом происходит быстро и отражает его функцию - обратимое связывание с кислородом, высвобождаемым гемоглобином, и освобождение в случае интенсивной физической нагрузки.!}
Ppt% 5C34928-slozhnye_belki_ch1_55.jpg "alt =" (! LANG:> Krivulje zasićenosti mioglobina i hemoglobina kisikom">!}
Ppt% 5C34928-slozhnye_belki_ch1_56.jpg "alt =" (! LANG:> CO2 i H+, nastali tokom katabolizma organskih supstanci, proporcionalno smanjuju afinitet hemoglobina za O2"> CO2 и Н+, образующиеся при катаболизме органических веществ, уменьшают сродство гемоглобина к О2 пропорционально их концентрации. Энергия, необходимая для работы клеток, вырабатывается преимущественно в митохондриях при окислении органических веществ с использованием O2, доставляемого из легких гемоглобином. В результате окисления органических веществ образуются конечные продукты их распада: СО2 и Н2O, количество которых пропорционально интенсивности протекающих процессов окисления. СO2 диффузией попадает из клеток в кровь и проникает в эритроциты, где под действием фермента карбоангидразы превращается в угольную кислоту. Эта слабая кислота диссоциирует на протон и бикарбонат ион. СО2 + Н2О → Н2СО3 → Н+ + НСО3-!}
Ppt% 5C34928-slozhnye_belki_ch1_57.jpg "alt =" (! LANG:> H+ joni su u stanju da se vežu za His146 radikale u β-lancima hemoglobina, odnosno u udaljenim područjima"> Ионы Н+ способны присоединятся к радикалам Гис146 в β-цепях гемоглобина, т.е. в участках, удаленных от гема. Протонирование гемоглобина снижает его сродство к О2, способствует отщеплению О2 от оксиНв, образованию дезоксиНв и увеличивает поступление кислорода в ткани пропорционально количеству образовавшихся протонов. Увеличение количества освобожденного кислорода в зависимости от увеличения концентрации Н+ в эритроцитах называется эффектом Бора (по имени датского физиолога Христиана Бора, впервые открывшего этот эффект). В легких высокое парциальное давление кислорода способствует его связыванию с дезоксиНв, что уменьшает сродство белка к Н+. Освободившиеся протоны под действием карбоангидразы взаимодействуют с бикарбонатами с образованием СО2 и Н2О!}
Ppt% 5C34928-slozhnye_belki_ch1_58.jpg "alt =" (! LANG:> Ovisnost afiniteta Hb za O2 od koncentracije CO2 i protona (Bohrov efekat): A -"> Зависимость сродства Нв к О2 от концентрации СО2 и протонов (эффект Бора): А - влияние концентрации СО2 и Н+ на высвобождение О2 из комплекса с Нв (эффект Бора); Б - оксигенирование дезоксигемоглобина в легких, образование и выделение СО2.!}
Ppt% 5C34928-slozhnye_belki_ch1_59.jpg "alt =" (! LANG:> Rezultirajući CO2 ulazi u alveolarni prostor i uklanja se izdahnutim zrakom."> Образовавшийся СО2 поступает в альвеолярное пространство и удаляется с выдыхаемым воздухом. Таким образом, количество высвобождаемого гемоглобином кислорода в тканях регулируется продуктами катаболизма органических веществ: чем интенсивнее распад веществ, например при физических нагрузках, тем выше концентрация СО2 и Н+ и тем больше кислорода получают ткани в результате уменьшения сродства Нв к О2.!}
Ppt% 5C34928-slozhnye_belki_ch1_60.jpg "alt =" (! LANG:> Promjena funkcionalne aktivnosti proteina pri interakciji s drugim ligandima zbog konformacijskih promjena naziva se alosterična"> Изменение функциональной активности белка при взаимодействии с другими лигандами вследствие конформационных изменений называется аллостерической регуляцией, а соединения-регуляторы - аллостерическими лигандами или эффекторами. Способность к аллостерической регуляции характерна, как правило, для олигомерных белков, т.е. для проявления аллостерического эффекта необходимо взаимодействие протомеров. При воздействии аллостерических лигандов белки меняют свою конформацию (в том числе и активного центра) и функцию.!}
Ppt% 5C34928-slozhnye_belki_ch1_61.jpg "alt =" (! LANG:> Alosterična regulacija afiniteta HB za O2 pomoću liganda 2,3-bis-fosfoglicerata. U eritrocitima iz proizvoda"> Аллостерическая регуляция сродства Нв к О2 лигандом - 2,3-бис-фосфоглицератом. В эритроцитах из продукта окисления глюкозы - 1,3-бисфосфоглицерата синтезируется аллостерический лиганд гемоглобина - 2,3-бисфосфоглицерат (2,3-БФГ). В нормальных условиях концентрация 2,3-БФГ высокая и сравнима с концентрацией Нв. 2,3-БФГ имеет сильный отрицательный заряд (-5).!}
Ppt% 5C34928-slozhnye_belki_ch1_62.jpg "alt =" (! LANG:> U centru tetramernog molekula hemoglobina nalazi se šupljina formirana od aminokiselinskih ostataka sva četiri protomera."> В центре тетрамерной молекулы гемоглобина находится полость. Ее образуют аминокислотные остатки всех четырех протомеров. В капиллярах тканей протонирование Нв (эффект Бора) приводит к разрыву связи между железом гема и О2. В молекуле дезоксигемоглобина по сравнению с оксигемоглобином возникают дополнительные ионные связи, соединяющие протомеры, вследствие чего размеры центральной полости по сравнению с оксигемоглобином увеличиваются. Центральная полость является местом присоединения 2,3-БФГ к гемоглобину. БФГ поступает в полость дезоксигемоглобина. 2,3-БФГ взаимодействует с гемоглобином в участке, удаленном от активных центров белка и относится к аллостерическим (регуляторным) лигандам, а центральная полость Нв является аллостерическим центром. 2,3-БФГ имеет сильный отрицательный заряд и взаимодействует с положительно заряженными группами двух β-цепей Нв. При этом его сродство к О2 снижается в 26 раз. В результате происходит высвобождение кислорода в капиллярах ткани при низком парциальном давлении О2. В легких высокое парциальное давление О2, наоборот, приводит к оксигенированию Нв и освобождению БФГ.!}
Ppt% 5C34928-slozhnye_belki_ch1_63.jpg "alt =" (! LANG:> Vezivni centar BFG nalazi se u pozitivno naelektrisanoj šupljini između 4 protomera hemoglobina."> Центр связывания БФГ находится в положительно заряженной полости между 4 протомерами гемоглобина. Взаимодействие БФГ с центром связывания изменяет конформацию α- и β-протомеров НЬ и их активных центров. Сродство НЬ к молекулам О2 снижается и кислород высвобождается в ткани. В легких при высоком парциальном давлении О2 активные центры гемоглобина насыщаются за счет изменения конформации и БФГ вытесняется из аллостерического центра!}
Ppt% 5C34928-slozhnye_belki_ch1_64.jpg "alt ="> ">
Ppt% 5C34928-slozhnye_belki_ch1_65.jpg "alt =" (! LANG:> Dakle, oligomerni proteini imaju nova svojstva u poređenju sa monomernim proteinima."> Таким образом, олигомерные белки обладают новыми по сравнению с мономерными белками свойствами. Присоединение лигандов на участках, пространственно удаленных друг от друга (аллостерических), способно вызывать конформационные изменения во всей белковой молекуле. Благодаря взаимодействию с регуляторными лигандами происходит изменение конформации и адаптация функции белковой молекулы к изменениям окружающей среды.!}
Ppt% 5C34928-slozhnye_belki_ch1_66.jpg "alt =" (! LANG:> Oko 15% ugljičnog dioksida prisutnog u krvi prenosi se molekulima hemoglobina."> Около 15% углекислого газа, присутствующего в крови, переносится молекулами гемоглобина. В тканях часть молекул углекислого газа может присоединится к каждому протомеру молекулы гемоглобина, при этом снижается сродство Hb к кислороду. В легких, наоборот, из-за высокого парциального давления кислорода, О2 связывается с Hb, а СО2 высвобождается.!}
Ppt% 5C34928-slozhnye_belki_ch1_67.jpg "alt ="> ">
Ppt% 5C34928-slozhnye_belki_ch1_68.jpg "alt =" (! LANG:> U molekuli hemoglobina S (tzv. abnormalni hemoglobin) su mutirana 2 β-lanca, u kojima"> В молекуле гемоглобина S (так назван аномальный гемоглобин) мутантными оказались 2 β-цепи, в которых глутамат, высокополярная отрицательно заряженная аминокислота в положении 6 была заменена валином, содержащим гидрофобный радикал.!}