A ligandum a komplex fehérjék lényeges összetevője. Fehérje funkció
Ligandumok - Ezek olyan anyagok, amelyek képesek specifikusan kötődni egy bizonyos szerkezetű molekulák aktív központjához.
Bioligandok Javaslom azoknak a ligandumoknak a megnevezését, amelyek az élő szervezetekben a célreceptor molekulákhoz való kötődésük révén bioregulációt végeznek. (© Sazonov V.F., 2012. © kineziolog.bodhy.ru, 2012.)
Ligandumok a bioregulációban (bioligandok) valójában jelző vezérlőanyagok, amelyek a rájuk specifikus molekuláris receptorok aktív központjához kötődnek, és képesek vezérlőparancsokat továbbítani.
Tehát ezt pontosan kijelenthetjük bioligandumok végrehajtani kemoreguláció , azaz a sejtek, egy szervezet, annak részei vagy organizmusok halmaza kémiai szabályozása.
A bioligandumok hatásmechanizmusa
A ligandumok fehérjék konformációjára gyakorolt hatása szerint a fehérje-ligandum kölcsönhatások több osztályba sorolhatók.
I. osztályú interakciók:
A ligandum a fehérjéhez kötődve nem okoz jelentős változást a konformációban, de stabilizálja a fehérje szerkezetét.
Példa erre a Ca2*-ionok lizozimmal való megkötése. Egy ligandum (Ca2-ionok) jelenlétében a lizozim denaturálásához a megfelelő szer (karbamid vagy guanidin-hidroklorid) nagy koncentrációja szükséges.
Nyilvánvalóan ebben az esetben Ca2 segítségével< образуются дополнительные связи между радикалами.
II. osztályú kölcsönhatások:
A ligandum jelentősen megváltoztatja a fehérje harmadlagos szerkezetét, és csak ebben az állapotban válik kellően aktívvá a fehérje.
Példa erre a Ca2*-ionok kalmodulinnal való megkötése, amely ezen ionok intracelluláris receptora. Két Ca2*-ion megkötésével a kalmodulin képessé válik számos sejtfehérje aktivitására.
III. osztályú kölcsönhatások:
Ligandum hiányában a fehérje az ún. az olvadt gömböcske állapota: meglehetősen tömör gömb alakú, de nincs határozott harmadlagos szerkezete - ez utóbbi csak a ligandum megkötésekor jön létre.
Ilyen fehérje például a laktalbumin (a laktózszintézis enzimkomplex komponense). Ez egy kisméretű fehérje, amely 4 diszulfid kötést tartalmaz, és erősen megköt 1 Ca * iont. Úgy tűnik, ez az ion kulcsfontosságú szerkezetalkotó elem. Ennek eltávolításakor a fehérje harmadlagos szerkezete megsemmisül. De a gömbölyű alakja és mérete a diszulfid kötések stabilizáló hatásának köszönhetően megmarad.
IV. osztályú interakciók:
Ligandum nélkül a fehérje másodlagos szerkezete nem alakul ki teljesen, és a harmadlagos szerkezet teljesen hiányzik. Ebben az esetben a peptidlánc részben feltekeredett.
Példa az oszteokalcin fehérjére, amely a csontmátrixban található. Csupán körülbelül 50 aminosavból áll, és 5 Ca-ion megkötésére képes." A kötődés a gömböcske térfogatának jelentős csökkenésével, harmadlagos szerkezet kialakulásával és a gömböcskék dimerré egyesülésével jár. ebben az esetben a ligandum szükséges egy kvaterner szerkezet megjelenéséhez a fehérjében.
V. osztályú interakciók:
Ligandum hiányában a fehérjelánc szinte teljesen ki van bontva, azaz véletlenszerű tekercs. A ligandummal való kölcsönhatás a fehérje térszerkezetének teljes kialakulásához vezet.
Példa erre a citokróm c, amely a mitokondriumok elektronszállító láncának egyik fehérje. Ligand hem (hasonlóan a hemoglobin hemhez). A téma eltávolítása a fehérjemolekula szinte teljes kibontakozásához vezet.
VI. osztályú interakciók:
A ligandumkötés a fehérjedomének vagy alegységek nagy léptékű eltolódását okozza.
Példa erre a hemoglobin (Hb) és az oxigén kölcsönhatása. E folyamat során számos és összetett konformációs átalakulás megy végbe. Beleértve a szomszédos alegységeket, egymáshoz képest 10 15"-kal elfordulnak.
Ennek eredményeként, amikor a 02 molekula az egyik alegység heméhez kötődik, a szomszédos alegységek oxigénaffinitása megnő. Ezt kooperatív hatásnak nevezik, és nagy élettani jelentőséggel bír.
Befejezésül két megjegyzést teszünk:
a) először is, amint látható, a ligandumok valóban nagyon jelentősen befolyásolhatják a fehérje konformációját;
b) másodszor, egy olyan fehérje esetében, amelynek több liganduma van (főleg, ha ez utóbbiak a molekula különböző részeihez kötődnek), az ilyen hatás természete a különböző ligandumokra teljesen eltérő lehet.
Például az olyan ligandumok, mint a hem és az oxigén, eltérő hatással vannak a hemoglobin szerkezetére.
Ezért az itt vázolt rendszerezés szerzőivel (V. N. Uversky és N. V. Narizhneva) ellentétben nem fehérjék osztályairól beszéltünk, hanem fehérje-ligandum kölcsönhatások osztályairól.
Vagy a központhoz kapcsolódó radikálisok. komplex vegyület atomja. Ők m. B. ionok (Н -, Hal -, NO 3 -, NCS - és mások), szervetlenek. molekulák (H 2, C n, N 2, P n, O 2, S n, CO, CO 2, NH 3, NO, SO 2, NO 2, COS stb.), org. Az V, VI, VII fő alcsoport elemeit tartalmazó kommunik. gr. időszakos rendszerek vagy p-donor funkció. Az L.-biológiailag fontos Comm. (, peptidek, purinok, corrinok,) és ezek szintetikus. analógokkal (koronaéterek), valamint donor atomokkal és kelátképző csoportokkal. L. a központhoz köthető. atom s-, p- és d-két- vagy többcentrikus kötések. Lítiumban kétcentrikus kötések kialakulása esetén donor centrumok (általában N, O, S, Cl vagy vagy atomok) különböztethetők meg. A multicentrikus kötés a p-aromás rendszernek köszönhetően történik. L. (, ciklopentadienid anion) vagy heteroaromás. L. (, tiofén, metil-piridinek). A legfontosabb mennyiségek. L. donor-akceptor képességére jellemző - fogászat, a koordinációban résztvevő L. donor központok száma határozza meg. Ennek alapján az L. mono-, di-, ... polidentátusra oszlik. Koordinátor. az egyfogú L. komplexképző szerek száma egybeesik a számukkal, mások esetében megegyezik az L. számának fogazatuk szorzatával. A L. természete határozza meg a koordináció típusait. konn. (, aminokomplexek, mol. adduktumok, kelátok, p-komplexek stb.); sv-va, szerkezet és reakció függ tőle. összetett kapcsolatok képessége. és gyakorlati lehetőségük. Alkalmazás. Világít.: Garnevsky A. D., "Felsőoktatási intézmények közleményei, Ser. Chemistry and Chemical Technology". 1987, 30. kötet, c. 10. o. 3-16; "Coord.", 1988, 14. kötet, c. 5. o. 579-99; Átfogó koordinációs kémia, v. 2-Ligands, Oxf. 1987. A. D. Garnovszkij.
Kémiai enciklopédia. - M .: Szovjet enciklopédia. Szerk. I. L. Knunyants. 1988 .
Nézze meg, mi a "LIGANDS" más szótárakban:
- (a latin ligo I bind szóból) például a központi atomhoz kapcsolódó komplex vegyületekben, molekulákban vagy ionokban (komplexképző szer). a LIGATURE kötőszóban (késő latin ligatura kapcsolat) 1) ... ... Nagy enciklopédikus szótár
ligandumok- (hozzáad) - ionok, gyökök vagy semleges molekulák, amelyek a központi ion (atom) körül koordinációs kötés kialakulása következtében helyezkednek el. Általános kémia: tankönyv / A. V. Zholnin ... Kémiai kifejezések
- (a latin ligo I kötődés szóból), komplex vegyületekben, a központi atomhoz (komplexképző szer) kapcsolódó molekulákban vagy ionokban, például a Cl3 vegyületben, a központi Co atomban és az NH3 molekula ligandumaiban. * * * A LIGANDA LIGANDAI (a lat. Ligo ... enciklopédikus szótár
- (a latin ligo I bind szóból) komplex vegyületekben (lásd: Összetett vegyületek) a központi atomhoz közvetlenül kötődő molekulák vagy ionok; ugyanaz, mint a kiegészítések... Nagy szovjet enciklopédia
- (a lat. ligo I connect), összetett sos. például egy központhoz, atomhoz (komplexképző szer) kapcsolódó molekulák vagy ionok. in conn. [Co (NH3) 6] C13 központ. a Co atom és az NH3 molekula L. ... Természettudomány. enciklopédikus szótár
- ... Wikipédia
Ligandumok- (lat. ligo - kapcsolódom). Specifikus endogén anyagok, amelyek gerjesztik bizonyos típusú sejtes agyi receptorokat - adrenerg, dopaminerg, kolinerg, szerotonerg, benzodiazepin, peptiderg stb. Pszichiátriai szakkifejezések magyarázó szótára
ligandumok- az andok, s, egységek ligája. h. ande, és... Orosz helyesírási szótár
Ligandumok- (latin ligo köt) endogén anyagok, amelyek neurotranszmitterek az agy szinapszisaiban (dopamin, acetilkolin, szerotonin stb.). A pszichotróp gyógyszereknek és a hallucinogéneknek is van néhány ligand tulajdonsága. * * * Biológiailag ...... Pszichológiai és pedagógiai enciklopédikus szótár
axiális ligandumok- ašiniai ligandai statusas T sritis chemija apibrėžtis Vienoje ašyje esantys ligandai. atitikmenys: angl. axiális ligandumok rus. axiális ligandumok ryšiai: sinonimas - aksialiniai ligandai ... Chemijos terminų aiškinamasis žodynas
Könyvek
- Az apoptózis immunológiai problémái, A. Yu. Baryshnikov, Yu. V. Shishkin. Az elmúlt évtizedet a programozott sejthalál (apoptózis) folyamatának viharos tanulmányozása jellemezte. Felszíni sejtreceptorok és ligandumaik, amelyek közvetítik...
A fehérje fő tulajdonsága, amely biztosítja a működését, szelektív kölcsönhatása egy bizonyos anyaggal - egy ligandummal.
A ligandumok lehetnek különböző természetű anyagok, mind kis molekulatömegű vegyületek, mind makromolekulák, beleértve a fehérjéket is. A fehérjemolekulákon vannak olyan helyek, amelyekhez a ligandum kapcsolódik - kötőhelyek vagy aktív helyek. A kötőhelyek aminosavmaradékokból jönnek létre, amelyek egy másodlagos és harmadlagos struktúra kialakítása eredményeként egyesülnek.
A fehérje és a ligandum közötti kötések lehetnek nem kovalensek és kovalensek. A fehérje és a ligandum kölcsönhatásának ("felismerésének") nagy specificitását a kötőcentrum szerkezetének komplementaritása biztosítja a ligandum térbeli szerkezetével.
A komplementaritás alatt a fehérje aktív helye és a ligandum közötti kémiai és térbeli megfelelést értjük. A protein P és az L ligandum közötti kölcsönhatást a következő egyenlet írja le:
fehérje + ligandum fehérje-ligandum komplex.
1. A fehérjék fő fizikai-kémiai tulajdonságai a molekulatömeg, az elektromos töltés és a vízben való oldhatóság. A fehérjék molekulatömege jelentősen változhat. Például az inzulin hormon molekulatömege körülbelül 6 ezer Igen, és az immunglobulin M - körülbelül 1 millió Igen. A fehérje molekulatömege az összetételét alkotó aminosavak számától, valamint a nem aminosav komponensek tömegétől függ. Egy aminosav átlagos tömege 110 Da. Így a fehérjében lévő aminosavak számának ismeretében megbecsülhető a molekulatömege és fordítva (N. N. Mushkambarov, 1995). A fehérje elektromos töltését a molekula felületén lévő pozitív és negatív töltésű csoportok aránya határozza meg. A fehérjerészecske töltése a közeg pH-jától függ. Az "izoelektromos pont" kifejezést egy fehérje jellemzésére használják. Az izoelektromos pont (pI) a közeg pH-értéke, amelynél a fehérjerészecske teljes töltése nulla. Az izoelektromos ponton a fehérjék a legkevésbé stabilak oldatban és könnyen kicsapódnak. A pI érték a savas és bázikus aminosavak arányától függ a fehérjében. A túlsúlyban savas aminosavakat tartalmazó fehérjék és peptidek (pH 7,0-nál negatív töltésűek) a pI értéke savas közegben van; a túlnyomórészt bázikus aminosavakat tartalmazó fehérjék és peptidek (7,0 pH-értéken pozitív töltésű) pI értéke savas közegben van. Az izoelektromos pont a fehérjék jellemző állandója, értéke az állati szövetek legtöbb fehérjéjére 5,5 és 7,0 között van, ami a savas aminosavak túlsúlyát jelzi összetételükben. A természetben azonban vannak olyan fehérjék, amelyekben az izoelektromos pont értéke a közeg szélsőséges pH-értékein van. A pepszin (a gyomornedv enzimje) pI értéke 1, a lizozimben (a mikroorganizmusok sejtfalát lebontó enzim) körülbelül 11. Egyes fehérjék molekulatömegének és izoelektromos pontjának értékei táblázatban vannak megadva. 1.4. táblázat A vérplazma és a szövetek fehérjéinek néhány állandója
A fehérjék oldhatósága vízben. A biofizikai kémia során ismeretes, hogy a fehérjék nagy molekulatömegű vegyületekként kolloid oldatokat képeznek. A fehérjeoldatok vízben való stabilitását a következő tényezők határozzák meg:
Ne feledje, hogy különféle fizikai és kémiai tényezők hatására a fehérjék kolloid oldatokból kicsapódhatnak. Megkülönböztetni:
Vegye figyelembe, hogy a fehérjekicsapódási reakciók a következő mechanizmusokon alapulhatnak:
Leggyakrabban a fehérjekicsapódást okozó tényezők hatását e mechanizmusok közül kettő vagy mindhárom kombinációja jellemzi. Biológiai aktivitás. Bármely fehérje működése azon a képességén alapul, hogy szelektíven kölcsönhatásba léphet szigorúan meghatározott molekulákkal vagy ionokkal - ligandumokkal. Például a kémiai reakciókat katalizáló enzimek esetében a ligandumok olyan anyagok, amelyek részt vesznek ezekben a reakciókban (szubsztrátok), valamint kofaktorok, aktivátorok és inhibitorok. A transzportfehérjékhez a ligandumok szállított anyagok stb. A ligandum képes kölcsönhatásba lépni a fehérjemolekula egy meghatározott részével - a kötőközponttal vagy az aktív központtal. Ezt a központot a fehérje harmadlagos szerkezetének szintjén térben közeli aminosavgyökök alkotják. A ligandum azon képessége, hogy kölcsönhatásba léphessen a kötőközponttal, komplementaritásuknak köszönhető, vagyis térszerkezetük kölcsönös komplementaritása (hasonlóan a "kulcszár" kölcsönhatáshoz). A ligandum funkciós csoportjai és a kötőhely között nem kovalens (hidrogén, ionos, hidrofób) kötések jönnek létre. A ligandum és a kötőhely komplementaritása magyarázhatja a fehérje-ligandum kölcsönhatás magas specificitását (szelektivitását). Tehát a különböző fehérjék fizikai-kémiai tulajdonságaikban és biológiai aktivitásukban különböznek egymástól. A fehérjekeverékek frakciókra való szétválasztására és az egyes enzimfehérjék izolálására szolgáló módszerek ezeken a különbségeken alapulnak. Ezeket a módszereket széles körben alkalmazzák az orvosi biokémiában és a biotechnológiában. 2. Fehérje denaturáció- ez a fehérje natív (természetes) fiziko-kémiai és legfőképpen biológiai tulajdonságainak megváltozása a kvaterner, harmadlagos, sőt másodlagos szerkezetének megsértése miatt. A fehérje denaturációját a következők okozhatják:
A denaturált fehérjéket a következők jellemzik:
Felhívjuk figyelmét, hogy bizonyos feltételek mellett lehetőség van a fehérje eredeti (natív) konformációjának helyreállítására a denaturációt okozó faktor eltávolítása után. Ezt a folyamatot lemondásnak nevezik. Emlékezzen néhány példára a fehérjedenaturációs folyamat orvosi felhasználására:
|
4 (1). A hemoglobin egy allosztérikus fehérje. Konformációs változások a hemoglobin molekulában. Kooperatív hatás. A hemoglobin oxigénhez való affinitásának szabályozói. A mioglobin és a hemoglobin szerkezeti és funkcionális különbségei.
Hemoglobin: alloszterikus fehérje
A monomer mioglobinról a tetramer hemoglobinra való evolúció folyamatában az átmenetet új tulajdonságok megjelenése kísérte. A hemoglobin molekula sokkal összetettebb, mint a mioglobin molekula. Mindenekelőtt a hemoglobin a 0 2 mellett H+-t és C02-t is szállít. Másodszor, az oxigén hemoglobin általi megkötését a belső környezet specifikus összetevői, nevezetesen a H +, CO2 és szerves foszforvegyületek szabályozzák. Ezek a szabályozók mély hatást gyakorolnak a hemoglobin oxigénmegkötő képességére, annak ellenére, hogy a hemtől távol eső területeken kötődnek a fehérjéhez. Általában az ún allosztérikus kölcsönhatás, azok. térben elkülönülő régiók közötti kölcsönhatások sok fehérjében fordulnak elő. Az alloszterikus hatások alapvető szerepet játszanak a biológiai rendszerek molekuláris folyamatainak szabályozásában és integrációjában. A hemoglobin a legtöbbet vizsgált alloszterikus fehérje, ezért érdemes alaposabban megvizsgálni szerkezetét és funkcióját.
A HEMOGLOBIN KONFORMÁCIÓS VÁLTOZÁSAI
Az oxigén megkötése a só felszakadásával jár
terminális karboxilcsoportok által létrehozott kötések
alegységek (7. ábra) Ez megkönnyíti a következő molekulák kötődését
oxigén, mivel ehhez kisebb szám felszakítása szükséges
sókötések. Ezek a változások jelentősen befolyásolják
másodlagos, harmadlagos és különösen kvaterner szerkezet
hemoglobin. Ebben az esetben egy A/B alegységpár fordul
egy másik A / B párhoz képest, ami tömörítéshez vezet
tetramer és a hemek oxigén iránti affinitásának növekedése (8. és 9. ábra).
KONFORMÁCIÓS VÁLTOZÁSOK A HEMOGROUP KÖRNYEZETÉBEN
A hemoglobin oxigénellátását szerkezeti kíséri
változások a hemocsoport környezetében. Ha oxigénnel van ellátva, az atom
vas, amely a dezoxihemoglobinban 0,06 nm-en hatott
a hemgyűrű síkja, ebbe a síkba húzódik (ábra.
10). A vasatomot követve közelebb kerül a hemhez
proximális hisztidin (F8), valamint a kapcsolódó szomszédos
A hemoglobin molekula kétféle lehet - feszült és ellazult. A hemoglobin ellazult formája 70-szer gyorsabban telítődik oxigénnel, mint a feszült. A feszült és ellazult forma frakcióinak változása a vérben lévő teljes hemoglobin mennyiségben meghatározza az oxihemoglobin disszociációs görbe S alakú formáját, és ennek következtében a hemoglobin oxigén iránti ún. Ha nagyobb a valószínűsége annak, hogy a hemoglobin stresszes formájából a relaxált állapotba kerül átmenet, akkor a hemoglobin oxigén iránti affinitása nő, és fordítva. A hemoglobin ezen frakcióinak kialakulásának valószínűsége több tényező hatására felfelé vagy lefelé változik. A fő tényező az oxigén kötődése a hemoglobin molekula heminikus szerkezetéhez. Sőt, minél több hemoglobin hemoglobin hemin köti meg az oxigént a vörösvértestekben, annál könnyebben megy át a hemoglobin molekula ellazult formába, és annál nagyobb affinitása az oxigénhez. Ezért a metabolikusan aktív szövetekben előforduló alacsony PO2 mellett a hemoglobin oxigén iránti affinitása kisebb, magas PO2 esetén pedig magasabb. Amint a hemoglobin megköti az oxigént, megnő az oxigén iránti affinitása, és a hemoglobinmolekula telítetté válik, amikor négy oxigénmolekulához kötődik. Amikor a hemoglobint tartalmazó vörösvértestek elérik a szöveteket, a vörösvértestekből származó oxigén bediffundál a sejtekbe. Az izmokban egyfajta oxigénraktárba kerül - a mioglobin molekulákba, amelyekből az oxigént az izmok biológiai oxidációjában használják fel. Az oxigén diffúziója az eritrocita hemoglobinból a szövetekbe a szövetekben lévő alacsony PO2 miatt - 35 Hgmm. Művészet. A szövetsejteken belül a normál anyagcsere fenntartásához szükséges oxigénfeszültség még alacsonyabb - nem több, mint 1 kPa. Ezért az oxigén diffúzió útján jut el a metabolikusan aktív sejtekhez a kapillárisokból. Egyes szövetek a vérkapillárisokban lévő alacsony PO2-koncentrációhoz alkalmazkodnak, amit a kapillárisok nagy sűrűsége kompenzál a szövetek térfogatára vonatkoztatva. Például a váz- és szívizmokban a kapilláris PO2 rendkívül gyorsan csökkenhet az összehúzódás során. Az izomsejtek egy mioglobin nevű fehérjét tartalmaznak, amely nagyobb affinitást mutat az oxigénhez, mint a hemoglobin. A mioglobin intenzíven telített oxigénnel, és elősegíti diffúzióját a vérből a váz- és szívizmokba, ahol meghatározza a biológiai oxidációs folyamatokat. Ezek a szövetek az oxigénnek akár 70%-át is képesek kivonni a rajtuk áthaladó vérből, ami a hemoglobin oxigén iránti affinitásának csökkenésének köszönhető a szöveti hőmérséklet és pH hatására. A pH és a hőmérséklet hatása a hemoglobin oxigénaffinitására. A hemoglobin molekulák képesek reagálni a hidrogénionokkal, ennek eredményeként a hemoglobin oxigén iránti affinitása csökken. Ha a hemoglobin telítettsége kisebb, mint 100%, az alacsony pH csökkenti az oxigén kötődését a hemoglobinhoz – az oxihemoglobin disszociációs görbe az x tengely mentén jobbra tolódik el. A hemoglobin tulajdonságainak ezt a változását hidrogénionok hatására Bohr-effektusnak nevezzük. A metabolikusan aktív szövetek savakat, például tejsavat és CO2-t termelnek. Ha a vérplazma pH-ja normál 7,4-ről 7,2-re csökken, ami az izomösszehúzódással következik be, akkor a Bohr-effektus hatására megnő benne az oxigénkoncentráció. Például 7,4 állandó pH-érték mellett a vér körülbelül 45% oxigént adna, azaz a hemoglobin oxigénnel való telítettsége 55% -ra csökken. Amikor azonban a pH 7,2-re csökken, a disszociációs görbe az x tengely mentén jobbra tolódik el. Ennek eredményeként a hemoglobin oxigénnel való telítettsége 40%-ra csökken, azaz a vér akár 60% oxigént is adhat a szövetekben, ami 1/3-ával több, mint állandó pH mellett. A metabolikusan aktív szövetek fokozzák a hőtermelést. A fizikai munka során fellépő szövethőmérséklet-emelkedés megváltoztatja a hemoglobinfrakciók arányát a vörösvértestekben, és az oxihemoglobin disszociációs görbéjének jobbra eltolódását okozza az x tengely mentén. Ennek eredményeként több oxigén szabadul fel a vörösvértestek hemoglobinjából, és kerül be a szövetekbe. A 2,3-difoszfoglicerát (2,3-DPG) hatása a hemoglobin oxigénaffinitására. Egyes fiziológiás körülmények között, például amikor a vér PO2-szintje a normál alá esik (hipoxia) annak következtében, hogy egy személy tengerszint feletti magasságban tartózkodik, a szövetek oxigénellátása elégtelenné válik. Hipoxia esetén a hemoglobin oxigén iránti affinitása csökkenhet az eritrociták 2,3-DPG-tartalmának növekedése miatt. A Bohr-effektussal ellentétben a hemoglobin oxigén iránti affinitásának csökkenése 2,3-DPG hatására nem reverzibilis a tüdő kapillárisaiban. Amikor azonban a vér átáramlik a tüdő kapillárisain, a 2,3-DPG hatása az eritrociták oxihemoglobin képződésének csökkenésére (az oxihemoglobin disszociációs görbe lapos része) kevésbé kifejezett, mint az oxigén felszabadulása a tüdő alatt. a 2,3-DPG hatása a szövetekben (a görbe ferde része), amely meghatározza a szövetek normál oxigénellátását
A natív háromdimenziós szerkezet számos energetikai és entróp tényező hatására jön létre. A fehérjemolekula konformációs állapotának különböző külső hatások (pH, hőmérséklet, ionösszetétel) hatására bekövetkező változása a funkcionális aktivitásában tükröződik. A konformációs átrendeződések nagyon gyorsan megtörténnek. Az első szakaszokban lokális mikrokonformációs jellegűek, csak egyes atomcsoportok elmozdulását okozzák. Az ilyen lokális elmozdulások kiterjesztése a makromolekuláris szerkezet többi részére általános konformációs változáshoz vezet a biopolimer molekulában.
Mioglobin- molekulánként egy 153 aminosavból álló polipeptidláncból és egy vas-porfirin csoportból (hem) áll. A mioglobin olyan hemoproteinekre utal, amelyek reverzibilisen képesek megkötni az oxigént; a vázizomsejtekben felelős az oxigén megőrzéséért, valamint a sejteken keresztüli diffúziója sebességének növeléséért. Filogenetikai szempontból a mioglobin a hemoglobin előfutára. A molekula nem tartalmaz diszulfid kötéseket, és 77%-os a-helicitás jellemzi. Az oxigén megkötéséért felelős hem egy speciális, erre szánt aminosavakból kialakított "hidrofób zsebben" található. A hem a protoporfirin makrociklusa, amelynek koordinált kétértékű vasionja a molekula közepén helyezkedik el. A hemnek ez a térbeli rögzítése lehetővé teszi az oxigénmolekula, mint hatodik ligandum megkötését.
Hemoglobin- "légzési" vérfehérje. Oxigént szállít a tüdő keringési rendszerén keresztül más szervekbe és fogyasztási központokba. A hemoglobin molekula négy páronként azonos polipeptidláncból áll, amelyek mindegyike hemet hordoz. A hemoglobin polipeptid láncait a-nak és b-nek nevezzük , és a molekula szimmetrikus szerkezetét 2 b 2-ként írjuk fel . A kvaterner szerkezet kialakítását az egyes polipeptidláncok közötti hidrofób kölcsönhatások végzik. Ha oxigént adunk a hemhez, oxihemoglobin képződik, amelynek kvaterner szerkezete csak kis mértékben tér el a nem oxigéntartalmú formától.
Az oxigén hozzáadása számos konformációs változást indukál a Hb-molekulában. Az oxigén megkötése a Fe 2+ ionnak az alacsony spinű állapotba való átvitelével együtt jár a vas egyidejű eltolódásával a hem csoport síkjába. Az a-alegységek közötti sóhidak fokozatos felszakadása következik be. Az a - alegységek hemei közötti távolság nő, a b alegységek hemei között pedig csökken. Általában az oxigenizáció átviszi az egyes alegységeket a dezoxi- és oxikonformációból. Hat sóhídból négy elszakadása az első két a-alegység oxigénezése során elősegíti a másik két híd felszakadását, és ezáltal megkönnyíti a következő oxigénmolekulák kötődését a fennmaradó alegységekhez, így több oxigénaffinitásukat is megnöveli. százszor. Ez a csatlakozás szövetkezeti jellege.
5. (1). A DNS elsődleges és másodlagos szerkezete. Chargaff szabályai. A komplementaritás elve. A DNS-molekulában lévő kötések típusai. A DNS biológiai szerepe. A molekuláris betegségek a génmutációk következményei.
A DNS elsődleges szerkezete a dezoxiribonukleozid-monofoszfátok (dNMP) váltakozási sorrendje a polinukleotid láncban.
A polinukleotid lánc minden foszfátcsoportja, a molekula 5 "végén lévő foszformaradék kivételével, két éterkötés kialakításában vesz részt két szomszédos dezoxiribóz 3" - és 5 "szénatomjának részvételével, ezért a monomerek közötti kötést 3", 5"-foszfodiészternek jelöljük.
A DNS terminális nukleotidjait szerkezetük különbözteti meg: a lánc 5 "végén egy foszfátcsoport, a 3" végén pedig egy szabad OH csoport található. Ezeket a végeket 5 "- és 3" végeknek nevezzük. A polimer DNS-láncban lévő dezoxiribonukleotidok lineáris szekvenciáját általában egybetűs kóddal rövidítik, például -A-G-C-T-T-A-C-A- 5-től 3-ig.
Mindegyik nukleinsav monomer tartalmaz egy foszforsav-maradékot. 7-es pH-értéken a foszfátcsoport tehát teljesen ionizált in vivo A nukleinsavak polianionként léteznek (több negatív töltéssel rendelkeznek). A pentózmaradékok hidrofil tulajdonságokat is mutatnak. A nitrogéntartalmú bázisok vízben szinte oldhatatlanok, de a purin- és pirimidingyűrű egyes atomjai képesek képződni hidrogénkötések.
A DNS másodlagos szerkezete. 1953-ban J. Watson és F. Crick javasolta a DNS térbeli szerkezetének modelljét. E modell szerint a DNS-molekula spirál alakú, amelyet két, egymáshoz képest és egy közös tengely körül csavart polinukleotid lánc alkot. Kettős spirál jobbkezes, polinukleotid lánc benne nem párhuzamos(4-6. ábra), i.e. ha az egyik a 3 "→ 5" irányba van orientálva, akkor a másik - az 5 "→ 3" irányba. Ezért mindkét végén
Rizs. 4-6. A DNS kettős hélixe. A DNS-molekulák két antiparallel szálból állnak, amelyek komplementer nukleotidszekvenciával rendelkeznek. A láncok egymáshoz képest jobbos spirálban vannak megcsavarodva úgy, hogy fordulatonként körülbelül 10 bázispár legyen.
A DNS-molekulák az egyik szál 5 "végén, a másik szál 3" végén találhatók.
A DNS-szálak összes bázisa a kettős hélix belsejében található, a pentóz-foszfát gerinc pedig azon kívül található. A polinukleotid láncokat a komplementer purin és pirimidin nitrogéntartalmú A és T (két kötés), valamint a G és C (három kötés) közötti hidrogénkötések tartják egymáshoz képest (4-7. ábra). Ezzel a kombinációval minden
Rizs. 4-7. Purin-pirimidin bázispárok a DNS-ben.
a pár három gyűrűt tartalmaz, így ezeknek a bázispároknak a teljes mérete a molekula teljes hosszában azonos. Hidrogénkötések lehetségesek más báziskombinációkhoz egy párban, de ezek sokkal gyengébbek. Az egyik szál nukleotidszekvenciája teljesen komplementer a második szál nukleotidszekvenciájával. Ezért Chargaff szabálya szerint (Erwin Chargaff 1951-ben a purin- és pirimidinbázisok arányának mintázatait állapította meg egy DNS-molekulában) a purinbázisok száma (A + G) megegyezik a pirimidinbázisok számával (T + C). .
A kiegészítő alapok a spirál magjában vannak egymásra rakva. Egy kétszálú molekula bázisai között a veremben, hidrofób kölcsönhatások, stabilizáló kettős spirál.
Ez a szerkezet kizárja a nitrogéntartalmú maradékok vízzel való érintkezését, de az alaphalmaz nem lehet teljesen függőleges. Az alappárok kissé el vannak tolva egymástól. A kialakított szerkezetben két horony különböztethető meg - egy nagy, 2,2 nm széles és egy kicsi, 1,2 nm széles. A fő- és kisebb barázdák régiójában lévő nitrogénbázisok kölcsönhatásba lépnek a kromatin szerkezetének szerveződésében részt vevő specifikus fehérjékkel.
Chargaff szabálya- empirikusan azonosított szabályok rendszere, amely leírja a DNS-ben található különböző típusú nitrogénbázisok közötti mennyiségi összefüggéseket. Erwin Chargaff biokémikus csoportjának 1949-1951 közötti munkája eredményeként fogalmazták meg.
Chargaff csoportjának munkája előtt az úgynevezett "tetranukleotid" elmélet uralkodott, amely szerint a DNS négy különböző nitrogénbázis (adenin, timin, guanin és citozin) ismétlődő blokkjaiból áll. Chargaff és munkatársai papírkromatográfiával el tudták választani a DNS-nukleotidokat, és meghatározták a különböző típusú nukleotidok pontos mennyiségi arányát. Jelentősen eltértek az ekvimolárisaktól, ami elvárható lenne, ha mind a négy bázist egyenlő arányban mutatnánk be. A Chargaff által az adenin (A), a timin (T), a guanin (G) és a citozin (C) aránya a következő volt:
1. Az adenin mennyisége megegyezik a timin mennyiségével, a guanin mennyisége pedig a citozin mennyiségével: A = T, G = C.
2. A purinok mennyisége megegyezik a pirimidinek mennyiségével: A + G = T + C.
3. A 6. pozícióban lévő aminocsoportokat tartalmazó bázisok száma megegyezik a 6. pozícióban lévő ketocsoportokat tartalmazó bázisok számával: A + C = G + T.
Ugyanakkor az (A + T) :( G + C) arány eltérő lehet a különböző típusú DNS-eknél. Néhányat az AT párok uralnak, míg másokban a GC-k.
Chargaff szabályai, valamint a röntgensugaras szerkezeti elemzés adatai döntő szerepet játszottak J. Watson és Francis Crick DNS szerkezetének megfejtésében.
Komplementaritás(v kémia, molekuláris biológiaés genetika) - a molekulák kölcsönös megfeleltetése biopolimerek vagy azok fragmensei, amelyek biztosítják a kötések kialakulását molekulák térben komplementer (komplementer) fragmentumai vagy szerkezeti fragmentumai között szupramolekuláris kölcsönhatások(hidrogénkötések kialakulása, hidrofób kölcsönhatások, töltött funkciós csoportok elektrosztatikus kölcsönhatásai stb.).
A komplementer fragmentumok vagy biopolimerek kölcsönhatása nem jár együtt kovalens képződéssel kémiai kötés komplementer fragmentumok között azonban a komplementer fragmentumok térbeli kölcsönös megfeleltetése miatt sok viszonylag gyenge kötés (hidrogén és van der Waals) képződéséhez vezet kellően magas összenergiával, ami stabil molekulakomplexek kialakulásához vezet.
Ugyanakkor meg kell jegyezni, hogy az enzimek katalitikus aktivitásának mechanizmusát az enzim komplementaritása és az átmeneti állapot vagy a katalizált reakció egy köztes terméke határozza meg - és ebben az esetben egy vegyi anyag reverzibilis képződése. kötés jöhet létre.
Nukleinsav komplementaritás
Mikor nukleinsavak- mind az oligo-, mind a polinukleotidok nitrogéntartalmú bázisok nukleotidok végzettsége miatt képes hidrogénkötések páros komplexeket alkotnak adenin-timin(vagy uracil v RNS) és guanin-citozin láncok kölcsönhatásában nukleinsavak... Ez a kölcsönhatás kulcsszerepet játszik a genetikai információ tárolásának és továbbításának számos alapvető folyamatában: DNS replikáció a genetikai információ átvitelének biztosítása a sejtosztódás során, átiratok DNS az RNS-be a szintézis során fehérjék DNS kódolt gén, genetikai információ tárolása a kettős szálú DNS-ben és DNS-javítási folyamatok, ha az megsérül.
A komplementaritás elvét alkalmazzák a DNS-szintézisben. Ez szigorú megfelelés a hidrogénkötésekkel összekapcsolt nitrogénbázisú vegyületnek, amelyben: AT ( Adenin-hoz kapcsolódik Timin) Г-Ц ( Guanin-hoz kapcsolódik Citozin)
Enzimatikus katalízis
A komplementer kötő enzim-szubsztrát kulcsfontosságú tényező az enzimaktivitás mechanizmusában, és a fentebb leírt helyzetekkel ellentétben a kémiailag nem kötött komplexek képződése esetén kémiai reakció megindulásához vezethet - kötés esetén enzim a szubsztráttal a komplementaritás viszonylag alacsony, azonban a szubsztrát átmeneti reakcióállapotával való nagy komplementaritás esetén ez az állapot stabilizálódik, ami az enzimek katalitikus aktivitásának hatásához vezet: az átmeneti állapot ilyen stabilizálása ekvivalens csökkenése aktiválási energiaés ennek megfelelően a reakciósebesség meredek növekedése.
Modul felépítés | Témák |
Moduláris egység 1 | 1.1. A fehérjék szerkezeti szerveződése. A natív fehérje konformáció kialakulásának szakaszai 1.2. A fehérjék működésének alapjai. Gyógyszerek, mint ligandumok, amelyek befolyásolják a fehérje működését 1.3. A fehérjék denaturációja és spontán megújulásuk lehetősége |
Moduláris egység 2 | 1.4. Az oligomer fehérjék szerkezetének és működésének jellemzői a hemoglobin példáján 1.5. A fehérjék natív konformációjának fenntartása sejtkörülmények között 1.6. Változatos fehérjék. Fehérjecsaládok, amint azt az immunglobulinok példázzák 1.7. A fehérjék fizikai-kémiai tulajdonságai és elválasztásuk módszerei |
1. moduláris egység A MONOMER FEHÉRJEK SZERKEZETI RENDEZÉSE ÉS MŰKÖDÉSÜK ALAPJA
Tanulási célok Ahhoz, hogy képes legyen:
1. Használja a fehérjék szerkezetének sajátosságaira és a fehérjék funkcióinak szerkezetétől való függőségére vonatkozó ismereteket az örökletes és szerzett proteinopátiák kialakulásának mechanizmusainak megértéséhez.
2. Magyarázza meg egyes gyógyszerek terápiás hatásának mechanizmusait, mint ligandumokat, amelyek kölcsönhatásba lépnek a fehérjékkel és megváltoztatják azok aktivitását.
3. Használja a fehérjék szerkezetére és konformációs labilitására vonatkozó ismereteket, hogy megértse szerkezeti és funkcionális instabilitását, valamint változó körülmények között a denaturálódását.
4. Ismertesse a denaturáló szerek használatát orvosi anyagok és műszerek sterilizálására, valamint antiszeptikumként.
Tud:
1. A fehérjék szerkezeti szerveződésének szintjei.
2. A fehérjék elsődleges szerkezetének értéke, amely meghatározza azok szerkezeti és funkcionális változatosságát.
3. A fehérjékben az aktív centrum kialakulásának mechanizmusa és specifikus kölcsönhatása a fehérjék működésének hátterében álló ligandummal.
4. Példák exogén ligandumok (gyógyszerek, toxinok, mérgek) hatására a fehérjék konformációjára és funkcionális aktivitására.
5. A fehérjedenaturáció okai és következményei, denaturációt okozó tényezők.
6. Példák a denaturáló faktorok felhasználására az orvostudományban antiszeptikumként és orvosi műszerek sterilizálására.
TÉMAKÖR 1.1. A FEHÉRJÉK SZERKEZETI RENDEZÉSE. A NATÍV KIALAKULÁSÁNAK SZAKASZAI
FEHÉRJE KONFORMÁCIÓK
A fehérjék polimer molekulák, amelyek monomerként mindössze 20 α-aminosavat tartalmaznak. Az aminosavak fehérjében való kombinálásának halmazát és sorrendjét az egyedek DNS-ében lévő gének szerkezete határozza meg. Minden fehérje sajátos szerkezetének megfelelően ellátja saját funkcióját. Az adott szervezet fehérjekészlete meghatározza annak fenotípusos jellemzőit, valamint az örökletes betegségek jelenlétét vagy azok kialakulására való hajlamot.
1. A fehérjéket alkotó aminosavak. Peptid kötés. A fehérjék monomerekből - 20 α-aminosavból - épülnek fel polimerek, amelyek általános képlete:
Az aminosavak szerkezetükben, méretükben, az α-szénatomhoz kapcsolódó gyökök fizikai-kémiai tulajdonságaiban különböznek egymástól. Az aminosavak funkciós csoportjai meghatározzák a különböző α-aminosavak tulajdonságainak jellemzőit. Az α-aminosavakban található gyökök több csoportra oszthatók:
prolin, A többi 19 fehérjemonomertől eltérően nem aminosav, hanem iminosav, a prolinban lévő gyök mind az α-szénatomhoz, mind az iminocsoporthoz kapcsolódik
 Az aminosavak vízben való oldhatóságukban különböznek egymástól. Ez annak köszönhető, hogy a gyökök képesek kölcsönhatásba lépni a vízzel (hidráttal).
Az aminosavak vízben való oldhatóságukban különböznek egymástól. Ez annak köszönhető, hogy a gyökök képesek kölcsönhatásba lépni a vízzel (hidráttal).
NAK NEK hidrofil magában foglalja az anionos, kationos és poláris, töltetlen funkciós csoportokat tartalmazó gyököket.
NAK NEK hidrofób A kifejezés magában foglalja a metilcsoportokat, alifás láncokat vagy ciklusokat tartalmazó gyököket.
2. A peptidkötések aminosavakat kapcsolnak peptidekké. A peptid szintézise során az egyik aminosav α-karboxilcsoportja kölcsönhatásba lép egy másik aminosav α-aminocsoportjával, így képződik peptid kötés:
A fehérjék polipeptidek, azaz. α-aminosavak peptidkötéssel összekapcsolt lineáris polimerjei (1.1. ábra)
 Rizs. 1.1. A peptidek szerkezetének leírására használt kifejezések
Rizs. 1.1. A peptidek szerkezetének leírására használt kifejezések
A polipeptideket alkotó aminosavak monomerjeit nevezzük aminosav-maradékok. Ismétlődő csoportok lánca - NH-CH-CO- nyomtatványok peptid gerinc. A szabad α-aminocsoporttal rendelkező aminosavakat N-terminálisnak, a szabad α-karboxilcsoportot C-terminálisnak nevezzük. A peptideket az N-terminálistól a C-terminálisig írják és olvassák.
A prolin iminocsoportja által kialakított peptidkötés eltér a többi peptidkötéstől: a peptidcsoport nitrogénatomja nem tartalmaz hidrogént,
ehelyett kötés van a gyökkel, ennek eredményeként a ciklus egyik oldala a peptid gerincébe kerül:
 A peptidek különböznek az aminosav-összetételben, az aminosavak számában és az aminosavak kombinálásának sorrendjében, például a Ser-Ala-Glu-Gis és a Gis-Glu-Ala-Ser két különböző peptid.
A peptidek különböznek az aminosav-összetételben, az aminosavak számában és az aminosavak kombinálásának sorrendjében, például a Ser-Ala-Glu-Gis és a Gis-Glu-Ala-Ser két különböző peptid.
A peptidkötések nagyon erősek, kémiai nem enzimatikus hidrolízisük szigorú feltételeket igényel: az elemzett fehérjét tömény sósavban hidrolizálják 110 °C körüli hőmérsékleten 24 órán át. Egy élő sejtben a peptidkötések megszakadhatnak proteolitikus enzimek, hívott proteázok vagy peptid hidrolázok.
3. A fehérjék elsődleges szerkezete. A különböző fehérjék peptidláncában az aminosavak nem véletlenszerűen váltakoznak, hanem meghatározott sorrendben helyezkednek el. A lineáris szekvenciát vagy az aminosavak váltakozási sorrendjét a polipeptidláncban nevezzük a fehérje elsődleges szerkezete.
Az egyes fehérjék elsődleges szerkezetét egy DNS-molekula kódolja (a genomnak nevezett régióban), és a transzkripció (az információ átírása az mRNS-re) és a transzláció (a fehérje elsődleges szerkezetének szintézise) során valósul meg. Ebből következően az egyén fehérjéinek elsődleges szerkezete a szülőktől a gyerekeknek örökletesen átadott információ, amely meghatározza az adott szervezet fehérjéinek szerkezeti jellemzőit, amelyektől a meglévő fehérjék működése függ (1.2. ábra).
 Rizs. 1.2. A genotípus és az egyed testében szintetizált fehérjék konformációja közötti kapcsolat
Rizs. 1.2. A genotípus és az egyed testében szintetizált fehérjék konformációja közötti kapcsolat
Az emberi szervezetben található körülbelül 100 000 egyedi fehérje mindegyike rendelkezik egyedi elsődleges szerkezete. Az egyik típusú fehérje (például az albumin) molekuláiban az aminosavak azonos váltakozása található, ami megkülönbözteti az albumint bármely más egyedi fehérjétől.
A peptidlánc aminosavainak szekvenciája az információrögzítés egy formájának tekinthető. Ez az információ határozza meg a lineáris peptidlánc térbeli felhajtását egy kompaktabb, háromdimenziós szerkezetté, ún. konformáció mókus. A funkcionálisan aktív fehérjekonformáció kialakulásának folyamatát ún összecsukható.
4. A fehérjék konformációja. A peptidvázban szabad forgás lehetséges a peptidcsoport nitrogénatomja és a szomszédos α-szénatom, valamint az α-szénatom és a karbonilcsoport szénatomja között. Az aminosavmaradékok funkcionális csoportjainak kölcsönhatása következtében a fehérjék primer szerkezete bonyolultabb térszerkezetekre tehet szert. A globuláris fehérjékben a peptidláncok konformációjának két fő szintje van: másodlagosés harmadlagos szerkezet.
A fehérjék másodlagos szerkezete a peptidváz -C = O és -NH- funkciós csoportjai közötti hidrogénkötések létrejöttének eredményeként kialakuló térszerkezet. Ebben az esetben a peptidlánc kétféle szabályos szerkezetet szerezhet: α-hélixés β-struktúrák.
V α-hélix hidrogénkötések jönnek létre a karbonilcsoport oxigénatomja és a belőle származó 4. aminosav amid-nitrogénjének hidrogénje között; aminosavak oldalláncai
A spirál perifériája mentén helyezkednek el, anélkül, hogy részt vennének a másodlagos szerkezet kialakításában (1.3. ábra).
A terjedelmes vagy azonos töltésű gyökök megakadályozzák az α-hélix kialakulását. A gyűrűs szerkezetű prolin megszakítja az α-hélixet, mivel a peptidláncban a nitrogénatomnál nincs hidrogén, ezért lehetetlen hidrogénkötést kialakítani. A nitrogén és az α-szénatom közötti kötés a prolin-ciklus része, ezért a peptidváz ezen a ponton meghajlik.
β-szerkezet egy polipeptid lánc peptidvázának lineáris régiói között képződik, így hajtogatott struktúrákat alkot. Polipeptidláncok vagy azok részei képződhetnek párhuzamos vagy antiparallel β-struktúrák. Az első esetben a kölcsönhatásba lépő peptidláncok N- és C-végei egybeesnek, a másodikban pedig ellenkező irányúak (1.4. ábra).
Rizs. 1.3. A fehérje másodlagos szerkezete - α-hélix
 Rizs. 1.4. Párhuzamos és antiparallel β-hajtogatott szerkezetek
Rizs. 1.4. Párhuzamos és antiparallel β-hajtogatott szerkezetek
A β-struktúrákat széles nyilak jelzik: A - Antiparallel β-struktúra. B - Párhuzamos β-hajtogatott szerkezetek
Egyes fehérjékben a különböző polipeptidláncok peptidvázának atomjai között hidrogénkötések kialakulása miatt β-struktúrák jöhetnek létre.
A fehérjékben is megtalálható szabálytalan másodlagos területek szerkezet, amely magában foglalja a polipeptid gerincének hajlításait, hurkokat és fordulatait. Gyakran olyan helyeken helyezkednek el, ahol a peptidlánc iránya megváltozik, például párhuzamos β-lemez szerkezet kialakulása során.
Az α-hélixek és β-struktúrák jelenléte szerint a globuláris fehérjék négy kategóriába sorolhatók.
Rizs. 1.5. A mioglobin (A) másodlagos szerkezete és a hemoglobin (B) β-láncai, amelyek nyolc α-hélixet tartalmaznak

 Rizs. 1.6. A trióz foszfát izomeráz és a piruvát kináz domén másodlagos szerkezete
Rizs. 1.6. A trióz foszfát izomeráz és a piruvát kináz domén másodlagos szerkezete
 Rizs. 1.7. Az immunglobulin (A) konstans doménjének másodlagos szerkezete és a szuperoxid-diszmutáz enzim (B)
Rizs. 1.7. Az immunglobulin (A) konstans doménjének másodlagos szerkezete és a szuperoxid-diszmutáz enzim (B)
V negyedik kategória kis mennyiségű szabályos másodlagos struktúrát tartalmazó fehérjéket tartalmaztak. Ide tartoznak a kisméretű, ciszteinben gazdag fehérjék vagy metalloproteinek.
A fehérje harmadlagos szerkezete- a peptidláncban egymástól jelentős távolságra elhelyezkedő aminosavgyökök közötti kölcsönhatások következtében kialakuló konformáció típusa. Ebben az esetben a legtöbb fehérje gömbölyűre emlékeztető térszerkezetet (globuláris fehérjék) alkot.
Mivel a hidrofób aminosav gyökök hajlamosak egyesülni az ún hidrofób kölcsönhatásokés intermolekuláris van der Waals erők hatására a fehérjegömb belsejében sűrű hidrofób mag képződik. A hidrofil ionizált és nem ionizált gyökök elsősorban a fehérje felszínén helyezkednek el, és meghatározzák annak vízoldhatóságát.
 Rizs. 1.8. A fehérje harmadlagos szerkezetének kialakulása során az aminosav gyökök között létrejövő kötések típusai
Rizs. 1.8. A fehérje harmadlagos szerkezetének kialakulása során az aminosav gyökök között létrejövő kötések típusai
1 - ionos kötés- pozitív és negatív töltésű funkciós csoportok között fordul elő;
2 - hidrogén kötés- töltés nélküli hidrofil csoport és bármely más hidrofil csoport között fordul elő;
3 - hidrofób kölcsönhatások- hidrofób gyökök között keletkeznek;
4 - diszulfid kötés- a cisztein-maradékok SH-csoportjainak oxidációja és egymással való kölcsönhatása következtében jön létre
A hidrofób mag belsejében rekedt hidrofil aminosavmaradékok kölcsönhatásba léphetnek egymással iónés hidrogénkötések(1.8. ábra).
Az ionos és hidrogénkötések, valamint a hidrofób kölcsönhatások a gyengék közé tartoznak: energiájuk nem sokkal nagyobb, mint a molekulák szobahőmérsékleten történő hőmozgásának energiája. A fehérje konformációja sok ilyen gyenge kötés megjelenésével megmarad. Mivel a fehérjét alkotó atomok állandó mozgásban vannak, egyes gyenge kötések felszakadhatnak, mások pedig kialakulhatnak, ami a polipeptidlánc egyes szakaszainak kismértékű elmozdulásához vezet. A fehérjéknek ezt a tulajdonságát, hogy egyesek felszakadása és más gyenge kötések kialakulása következtében konformációt változtatnak, az ún. konformációs labilitás.
Az emberi testnek vannak olyan rendszerei, amelyek támogatják homeosztázis- a belső környezet állandósága bizonyos, az egészséges szervezet számára megengedett határokon belül. Homeosztázis körülmények között a konformáció kis változásai nem bontják meg a fehérjék általános szerkezetét és működését. A fehérje funkcionálisan aktív konformációját ún natív felépítés. A belső környezet megváltozása (például a glükóz, Ca-ionok, protonok stb. koncentrációja) a fehérjék konformációjának megváltozásához és működési zavarához vezet.
Egyes fehérjék harmadlagos szerkezete stabilizálódik diszulfid kötések, két aminosavból álló -SH csoportok kölcsönhatása következtében jött létre
 Rizs. 1.9. Diszulfid kötés kialakulása fehérjemolekulában
Rizs. 1.9. Diszulfid kötés kialakulása fehérjemolekulában
cisztein (1.9. ábra). A legtöbb intracelluláris fehérje harmadlagos szerkezetében nincs kovalens diszulfidkötés. Jelenlétük a sejt által kiválasztott fehérjékre jellemző, ami biztosítja azok nagyobb stabilitását extracelluláris körülmények között. Tehát diszulfid kötések találhatók az inzulin és az immunglobulin molekulákban.
Inzulin- a hasnyálmirigy β-sejtjeiben szintetizált fehérjehormon, amely a vérben lévő glükózkoncentráció növekedésére válaszul választódik ki a vérbe. Az inzulin szerkezetében két diszulfid kötés köti össze a polipeptid A- és B-láncát, és egy diszulfidkötés az A-láncon belül (1.10. ábra).
 Rizs. 1.10. Diszulfid kötések az inzulin szerkezetében
Rizs. 1.10. Diszulfid kötések az inzulin szerkezetében
5. A fehérjék szuperszekunder szerkezete. Azokban a fehérjékben, amelyek elsődleges szerkezetükben és funkciójukban különböznek, másodlagos szerkezetek hasonló kombinációi és elrendezése, amelyeket szuperszekunder szerkezetnek nevezünk. Közbenső helyet foglal el a másodlagos és harmadlagos szerkezetek között, mivel ez a másodlagos szerkezet elemeinek specifikus kombinációja a fehérje harmadlagos szerkezetének kialakításában. A szuperszekunder struktúráknak sajátos neveik vannak, mint például „α-hélix-turn-a-helix”, „leucin-cipzár”, „cink ujjak”, stb. Az ilyen szuperszekunder struktúrák a DNS-kötő fehérjékre jellemzőek.
Leucin cipzár. Ez a fajta szuperszekunder szerkezet két fehérje összekapcsolására szolgál. A kölcsönhatásba lépő fehérjék felületén α-helikális régiók találhatók, amelyek legalább négy leucinmaradékot tartalmaznak. Az α-hélixben található leucinmaradékok hat aminosav távolságra helyezkednek el egymástól. Mivel az α-hélix minden köre 3,6 aminosavból áll, ezért minden második körben leucin gyökök találhatók. Egy fehérje α-hélixének leucin-maradékai kölcsönhatásba léphetnek egy másik fehérje leucin-maradékaival (hidrofób kölcsönhatások), összekapcsolva azokat (1.11. ábra). Számos DNS-kötő fehérje oligomer komplexek részeként működik, ahol az egyes alegységek "leucin kötőanyagokkal" kötődnek egymáshoz.
 Rizs. 1.11. "Leucin cipzár" két fehérje α-helikális régiói között
Rizs. 1.11. "Leucin cipzár" két fehérje α-helikális régiói között
Ilyen fehérjék például a hisztonok. Hisztonok- nukleáris fehérjék, amelyek nagyszámú pozitív töltésű aminosavat tartalmaznak - arginin és lizin (akár 80%). A hisztonmolekulákat nyolc monomert tartalmazó oligomer komplexekké egyesítik "leucin kötőelemek" segítségével, annak ellenére, hogy ezeknek a molekuláknak az azonos nevű jelentős töltése van.
"Cink ujj"- a szuperszekunder struktúra DNS-kötő fehérjékre jellemző variánsa, a fehérje felületén megnyúlt fragmentum formájában van, és körülbelül 20 aminosavból áll (1.12. ábra). A "megnyúlt ujj" formáját egy cinkatom támogatja, amely négy aminosav gyökéhez kapcsolódik - két cisztein és két hisztidin. Egyes esetekben a hisztidin-maradékok helyett cisztein-maradékok vannak. Két szorosan elhelyezkedő cisztein-maradékot körülbelül 12 aminosavból álló szekvencia választ el a másik két Gisili-maradéktól. A fehérjének ez a régiója egy α-hélixet alkot, amelynek gyökei specifikusan kötődhetnek a DNS fő barázdájának szabályozó régióihoz. Az egyed kötési sajátossága
 Rizs. 1.12. A "cink ujj" szerkezetét alkotó DNS-kötő fehérjék régiójának elsődleges szerkezete (a betűk a szerkezetet alkotó aminosavakat jelölik)
Rizs. 1.12. A "cink ujj" szerkezetét alkotó DNS-kötő fehérjék régiójának elsődleges szerkezete (a betűk a szerkezetet alkotó aminosavakat jelölik)
szabályozó DNS-kötő fehérje a „cink ujjban” elhelyezkedő aminosavak szekvenciájától függ. Az ilyen struktúrák különösen a transzkripció szabályozásában (DNS-ből RNS-be történő információ olvasásában) részt vevő szteroid hormonok receptorait tartalmazzák.
TÉMAKÖR 1.2. A FEHÉRJÉK MŰKÖDÉSÉNEK ALAPJAI. A FEHÉRJÉK MŰKÖDÉSÉT BEFOLYÁSOLÓ GYÓGYSZEREK MINT LIGANDUMOK
1. A fehérje aktív centruma és kölcsönhatása a ligandummal. A funkcionálisan aktív fehérje felületén, általában depresszióban, harmadlagos struktúra kialakulása során olyan régió képződik, amelyet az elsődleges szerkezetben egymástól távol eső aminosavgyökök alkotnak. Ezt a helyet, amely egy adott fehérje számára egyedi szerkezettel rendelkezik, és képes specifikusan kölcsönhatásba lépni egy bizonyos molekulával vagy hasonló molekulák csoportjával, fehérje-ligandum kötőhelynek vagy aktív helynek nevezzük. A ligandumok olyan molekulák, amelyek kölcsönhatásba lépnek a fehérjékkel.
Magas specifitás a fehérje és a ligand kölcsönhatását az aktív centrum szerkezetének a ligandum szerkezetével való komplementaritása biztosítja.
Komplementaritás a kölcsönható felületek térbeli és kémiai megfelelése. Az aktív centrumnak nemcsak térben kell megfelelnie a benne lévő ligandumnak, hanem kötéseknek (ionos, hidrogénes és hidrofób kölcsönhatásoknak is) kell kialakulniuk az aktív centrumban lévő gyökök funkcionális csoportjai és a ligandumot tartó ligandum között. az aktív központban (1.13. ábra).
 Rizs. 1.13. Egy fehérje és egy ligandum komplementer kölcsönhatása
Rizs. 1.13. Egy fehérje és egy ligandum komplementer kölcsönhatása
Egyes ligandumok a fehérje aktív központjához kapcsolódva kisegítő szerepet játszanak a fehérjék működésében. Az ilyen ligandumokat kofaktoroknak, a nem fehérje részt tartalmazó fehérjéket pedig nevezzük komplex fehérjék(szemben az egyszerű fehérjékkel, amelyek csak a fehérje részből állnak). A fehérjéhez szilárdan kötődő, nem fehérje részt ún protézis csoport. Például a mioglobin, a hemoglobin és a citokrómok összetétele tartalmaz egy protetikus csoportot, amely szilárdan kapcsolódik az aktív központhoz - hem, amely vasiont tartalmaz. A hemet tartalmazó komplex fehérjéket hemoproteineknek nevezzük.
Amikor specifikus ligandumok kapcsolódnak a fehérjékhez, ezeknek a fehérjéknek a funkciója megnyilvánul. Tehát az albumin - a vérplazma legfontosabb fehérje - transzport funkcióját úgy fejti ki, hogy hidrofób ligandumokat köt az aktív centrumhoz, mint például zsírsavak, bilirubin, egyes gyógyszerek stb. (1.14. ábra).
A peptidlánc háromdimenziós szerkezetével kölcsönhatásba lépő ligandumok nemcsak kis molekulatömegű szerves és szervetlen molekulák, hanem makromolekulák is lehetnek:
DNS (a fenti példák DNS-kötő fehérjékkel);
poliszacharidok;
 Rizs. 1.14. A genotípus és a fenotípus kapcsolata
Rizs. 1.14. A genotípus és a fenotípus kapcsolata
Az emberi fehérjék egyedi elsődleges szerkezete, amelyet a DNS-molekula kódol, a sejtekben a fehérjék egyedi konformációja, aktív centrumának szerkezete és funkciói formájában valósul meg.
Ezekben az esetekben a fehérje felismer egy specifikus ligandumot, amely arányos és komplementer a kötőhellyel. Tehát a hepatociták felszínén az inzulin hormon receptorfehérjei találhatók, amelynek fehérjeszerkezete is van. Az inzulin és a receptor kölcsönhatása változást okoz annak konformációjában és aktiválja a jelátviteli rendszereket, ami evés után tápanyagok felhalmozódásához vezet a hepatocitákban.
Ily módon a fehérjék működése a fehérje aktív centrumának a ligandummal való specifikus kölcsönhatásán alapul.
2. A domén szerkezete és szerepe a fehérjék működésében. A globuláris fehérjék hosszú polipeptidláncai gyakran több kompakt, viszonylag független régióba hajtódnak össze. Független harmadlagos szerkezettel rendelkeznek, hasonlóan a globuláris fehérjékhez, és ún domainek. A fehérjék doménszerkezetének köszönhetően könnyebben alakul ki harmadlagos szerkezetük.
A doménfehérjékben a ligandumkötő helyek gyakran a domének között helyezkednek el. Tehát a tripszin egy proteolitikus enzim, amelyet a hasnyálmirigy exokrin része termel, és szükséges az élelmiszer-fehérjék emésztéséhez. Kétdoménes szerkezetű, és a tripszin kötőhelye ligandumával, egy élelmiszerfehérjével a két domén közötti barázdában található. Az aktív központban olyan feltételek jönnek létre, amelyek szükségesek a táplálékfehérje egy adott helyének hatékony megkötéséhez és peptidkötéseinek hidrolíziséhez.
Amikor az aktív centrum kölcsönhatásba lép a ligandummal, a fehérjében lévő különböző domének egymáshoz képest elmozdulhatnak (1.15. ábra).
Hexokináz- egy enzim, amely ATP segítségével katalizálja a glükóz foszforilációját. Az enzim aktív helye a két domén közötti hasadékban található. Amikor a hexokináz glükózhoz kötődik, a környező domének bezáródnak, és a szubsztrát beszorul, ahol foszforiláció megy végbe (lásd 1.15. ábra).
 Rizs. 1.15. A hexokináz domének kötődése glükózhoz
Rizs. 1.15. A hexokináz domének kötődése glükózhoz
Egyes fehérjékben a domének független funkciókat látnak el, különféle ligandumokhoz kötődve. Ezeket a fehérjéket multifunkcionálisnak nevezzük.
3. Gyógyszerek - ligandumok, amelyek befolyásolják a fehérjék működését. A fehérjék ligandumokkal való kölcsönhatása specifikus. A fehérje és az aktív centrum konformációs labilitása miatt azonban lehetőség van egy másik olyan anyag kiválasztására, amely szintén kölcsönhatásba léphet az aktív centrumban vagy a molekula más részében lévő fehérjével.
A természetes ligandumhoz hasonló szerkezetű anyagot ún a ligandum szerkezeti analógja vagy természetellenes ligandum. Az aktív helyen lévő fehérjével is kölcsönhatásba lép. A ligandum szerkezeti analógja egyaránt fokozhatja a fehérje működését (agonista), tehát csökkentse (antagonista). A ligandum és szerkezeti analógjai versengenek egymással az azonos központban lévő fehérjéhez való kötődésért. Az ilyen anyagokat ún versenyképes modulátorok fehérjefunkciók (szabályozói). Sok gyógyszer fehérje inhibitorként működik. Ezek egy részét természetes ligandumok kémiai módosításával állítják elő. A fehérje inhibitorok lehetnek gyógyszerek és mérgek.
Az atropin az M-kolinerg receptorok kompetitív inhibitora. Az acetilkolin egy neurotranszmitter az idegimpulzusok kolinerg szinapszisokon keresztül történő továbbítására. A gerjesztés végrehajtásához a szinaptikus hasadékba felszabaduló acetilkolinnak kölcsönhatásba kell lépnie egy fehérjével - a posztszinaptikus membrán receptorával. Két típust találtunk kolinerg receptorok:
M-receptor, az acetilkolinon kívül szelektív kölcsönhatásba lép a muszkarinnal (légyölő galóca toxin). M - kolinerg receptorok jelen vannak a simaizmokon, és az acetilkolinnal kölcsönhatásba lépve összehúzódásukat okozzák;
H-receptor, specifikusan kötődik a nikotinhoz. A H-kolinerg receptorok a harántcsíkolt vázizmok szinapszisaiban találhatók.
Specifikus inhibitor M-kolinerg receptorok az atropin. Belladonna és tyúkszem növényekben található.
 Az atropin szerkezetében az acetilkolinhoz hasonló funkcionális csoportokat és azok térbeli elrendezését tartalmazza, ezért az M-kolinerg receptorok kompetitív inhibitorai közé tartozik. Tekintettel arra, hogy az acetilkolin M-kolinerg receptorokhoz való kötődése a simaizmok összehúzódását okozza, az atropint izomgörcsöket enyhítő gyógyszerként használják. (görcsoldó). Tehát az atropin használata köztudottan ellazítja a szemizmokat a szemfenék megtekintésekor, valamint enyhíti a görcsöket a gyomor-bélrendszeri kólikában. Az M-kolinerg receptorok a központi idegrendszerben (CNS) is jelen vannak, ezért nagy dózisú atropin nemkívánatos reakciókat válthat ki a központi idegrendszerből: motoros és mentális izgatottságot, hallucinációkat, görcsöket.
Az atropin szerkezetében az acetilkolinhoz hasonló funkcionális csoportokat és azok térbeli elrendezését tartalmazza, ezért az M-kolinerg receptorok kompetitív inhibitorai közé tartozik. Tekintettel arra, hogy az acetilkolin M-kolinerg receptorokhoz való kötődése a simaizmok összehúzódását okozza, az atropint izomgörcsöket enyhítő gyógyszerként használják. (görcsoldó). Tehát az atropin használata köztudottan ellazítja a szemizmokat a szemfenék megtekintésekor, valamint enyhíti a görcsöket a gyomor-bélrendszeri kólikában. Az M-kolinerg receptorok a központi idegrendszerben (CNS) is jelen vannak, ezért nagy dózisú atropin nemkívánatos reakciókat válthat ki a központi idegrendszerből: motoros és mentális izgatottságot, hallucinációkat, görcsöket.
A ditilin a H-kolinerg receptorok kompetitív agonistája, amely gátolja a neuromuszkuláris szinapszisok működését.
 A vázizom neuromuszkuláris szinapszisai H-kolinerg receptorokat tartalmaznak. Az acetilkolinnal való kölcsönhatásuk izomösszehúzódásokhoz vezet. Egyes sebészeti eljárások, valamint az endoszkópos vizsgálatok olyan gyógyszereket alkalmaznak, amelyek a vázizmok ellazulását okozzák (izomrelaxánsok). Ide tartozik a ditilin, amely az acetilkolin szerkezeti analógja. H-kolinerg receptorokhoz kötődik, de az acetilkolintól eltérően az acetilkolinészteráz enzim nagyon lassan tönkreteszi. Az ioncsatornák elhúzódó megnyitása és a membrán tartós depolarizációja következtében az idegimpulzusok vezetése megszakad, és izomrelaxáció következik be. Kezdetben ezeket a tulajdonságokat a curare méregben találták meg, ezért az ilyen gyógyszereket nevezik curariform.
A vázizom neuromuszkuláris szinapszisai H-kolinerg receptorokat tartalmaznak. Az acetilkolinnal való kölcsönhatásuk izomösszehúzódásokhoz vezet. Egyes sebészeti eljárások, valamint az endoszkópos vizsgálatok olyan gyógyszereket alkalmaznak, amelyek a vázizmok ellazulását okozzák (izomrelaxánsok). Ide tartozik a ditilin, amely az acetilkolin szerkezeti analógja. H-kolinerg receptorokhoz kötődik, de az acetilkolintól eltérően az acetilkolinészteráz enzim nagyon lassan tönkreteszi. Az ioncsatornák elhúzódó megnyitása és a membrán tartós depolarizációja következtében az idegimpulzusok vezetése megszakad, és izomrelaxáció következik be. Kezdetben ezeket a tulajdonságokat a curare méregben találták meg, ezért az ilyen gyógyszereket nevezik curariform.
TÉMAKÖR 1.3. A FEHÉRJÉK DENATURÁLÁSA ÉS SPONTÁN RENATIVÁLÁSUK LEHETŐSÉGE
1. Mivel a fehérjék natív konformációja a gyenge kölcsönhatások miatt megmarad, a fehérjét körülvevő környezet összetételének és tulajdonságainak változása, a kémiai reagenseknek és fizikai tényezőknek való kitettség változást okoz a konformációjukban (konformációs labilitás tulajdonsága). A nagyszámú kötés felszakadása a fehérjék natív konformációjának megsemmisüléséhez és denaturálásához vezet.
Fehérje denaturáció- ez a natív konformációjuk denaturáló szerek hatására bekövetkező pusztulása, amit a fehérje térszerkezetét stabilizáló gyenge kötések felszakadása okoz. A denaturáció a fehérje egyedi háromdimenziós szerkezetének és aktív centrumának tönkremenetelével és biológiai aktivitásának elvesztésével jár (1.16. ábra).
Egy fehérje összes denaturált molekulája véletlenszerű konformációt kap, amely különbözik ugyanazon fehérje többi molekulájától. Az aktív centrumot alkotó aminosavgyökök egymástól térben távol helyezkednek el, pl. a fehérje ligandummal való specifikus kötőhelye elpusztul. A denaturáció során a fehérjék elsődleges szerkezete változatlan marad.
Denaturáló szerek alkalmazása a biológiai kutatásban és az orvostudományban. A biokémiai vizsgálatok során a biológiai anyagokban található kis molekulatömegű vegyületek meghatározása előtt általában először a fehérjéket távolítják el az oldatból. Erre a célra leggyakrabban triklór-ecetsavat (TCA) használnak. Miután TCA-t adtunk az oldathoz, a denaturált fehérjék kicsapódnak, és szűréssel könnyen eltávolíthatók (1.1. táblázat).
A gyógyászatban a denaturáló szereket gyakran használják orvosi műszerek és anyagok sterilizálására autoklávokban (denaturáló szer - magas hőmérséklet), valamint antiszeptikumként (alkohol, fenol, klóramin) a kórokozó mikroflórát tartalmazó szennyezett felületek kezelésére.
2. Spontán fehérje megújulás- a fehérjék elsődleges szerkezetének, konformációjának és működésének determinizmusának bizonyítása. Az egyes fehérjék egy gén termékei, amelyek azonos aminosav-szekvenciával rendelkeznek, és azonos konformációt kapnak a sejtben. Azt az alapvető következtetést, hogy a fehérje elsődleges szerkezete már tartalmaz információkat a konformációjáról és funkciójáról, egyes fehérjék (különösen a ribonukleáz és a mioglobin) spontán regenerációs képessége alapján tették le – a denaturáció utáni natív konformációjuk helyreállítására.
A fehérje térszerkezetének kialakítása önszerveződési módszerrel történik - egy spontán folyamat, amelyben egy egyedi primer szerkezettel rendelkező polipeptidlánc hajlamos a legalacsonyabb szabadenergiájú konformáció elfogadására oldatban. A ribonukleáz enzimmel végzett kísérletben leírták a denaturáció után elsődleges szerkezetüket megőrző fehérjék megújításának képességét.
A ribonukleáz egy enzim, amely lebontja az egyes nukleotidok közötti kötéseket egy RNS-molekulában. Ennek a globuláris fehérjének egy polipeptidlánca van, amelynek harmadlagos szerkezetét sok gyenge és négy diszulfidkötés stabilizálja.
A ribonukleáz karbamiddal, amely tönkreteszi a molekulában a hidrogénkötéseket, és egy redukálószerrel, amely megszakítja a diszulfid kötéseket, az enzim denaturálásához és aktivitásának elvesztéséhez vezet.
A denaturáló szerek dialízissel történő eltávolítása a fehérje konformációjának és működésének helyreállítását eredményezi, azaz. a megújuláshoz. (1.17. ábra).
 Rizs. 1.17. A ribonukleáz denaturációja és reneszánsza
Rizs. 1.17. A ribonukleáz denaturációja és reneszánsza
A - a ribonukleáz natív konformációja, amelynek tercier szerkezetében négy diszulfidkötés található; B - denaturált ribonukleáz molekula;
B - újjáélesztett ribonukleáz molekula csökkent szerkezettel és funkcióval
1. Töltse ki az 1.2. táblázatot.
1.2. táblázat. Az aminosavak csoportosítása gyökpolaritás szerint
2. Írd fel a tetrapeptid képletét:
Asp - Pro - Fen - Liz
a) izoláljuk a peptidben a peptidvázat alkotó ismétlődő csoportokat és az aminosavgyökök által képviselt variábilis csoportokat;
b) jelölje ki az N- és C-végeket;
c) aláhúzzuk a peptidkötéseket;
d) írjon egy másik peptidet, amely ugyanazokból az aminosavakból áll;
e) számolja meg a hasonló aminosav-összetételű tetrapeptid lehetséges változatainak számát.
3. Magyarázza meg a fehérjék elsődleges szerkezetének szerepét az emlős neurohypophysis két szerkezetileg hasonló és evolúciósan közeli peptidhormon - az oxitocin és a vazopresszin - összehasonlító elemzésével (1.3. táblázat).
1.3. táblázat. Az oxitocin és a vazopresszin felépítése és működése
 Ezért:
Ezért:
a) hasonlítsa össze a két peptid összetételét és aminosav-szekvenciáját;
b) találja meg két peptid primer szerkezetének hasonlóságát és biológiai hatásuk hasonlóságát;
c) találja meg a két peptid szerkezetének és funkcióinak különbségét;
d) következtetések levonása a peptidek primer szerkezetének a funkciójukra gyakorolt hatásáról.
4. Ismertesse a globuláris fehérjék konformációjának kialakulásának főbb állomásait (másodlagos, harmadlagos szerkezetek, a szuperszekunder szerkezet fogalma). Jelölje be a fehérjeszerkezetek kialakításában részt vevő kötések típusait! Milyen aminosav gyökök vehetnek részt hidrofób kölcsönhatások, ionos, hidrogénkötések kialakításában.
Adj rá példákat.
5. Adja meg a „fehérjék konformációs labilitása” fogalmának definícióját, jelölje meg létezésének okait és jelentőségét!
6. Bővítse ki a következő kifejezés jelentését: "A fehérjék működése a ligandummal való specifikus kölcsönhatáson alapul", a kifejezések használatával és jelentésük magyarázatával: fehérje konformáció, aktív centrum, ligandum, komplementaritás, fehérje funkciója.
7. Egy példa segítségével magyarázza el, mik azok a domének, és mi a szerepük a fehérjékben.
ÖNIRÁNYÍTÁSI FELADATOK
1. Hozzon létre levelezést.
Funkcionális csoport az aminosav gyökben:
A. Karboxilcsoport B. Hidroxilcsoport C Guanidincsoport D. Tiolcsoport D. Aminocsoport
2. Válaszd ki a helyes válaszokat.
A poláris töltetlen gyököket tartalmazó aminosavak a következők:
A. Cis B. Asn
B. Glu G. Három
3. Válaszd ki a helyes válaszokat.
Aminosav gyökök:
A. Adja meg az elsődleges szerkezet sajátosságait B. Vegyen részt a harmadlagos struktúra kialakításában
B. A fehérje felszínén található, befolyásolja oldhatóságát D. Aktív központot képez
E. Részt vesz a peptidkötések kialakításában
4. Válaszd ki a helyes válaszokat.
Az aminosav gyökök között hidrofób kölcsönhatások alakulhatnak ki:
A. Tre Lei B. Pro Three
B. Met Ile G. Tir Ala D. Val Fen
5. Válaszd ki a helyes válaszokat.
Az aminosav gyökök között ionos kötések alakulhatnak ki:
A. Gln Asp B. Apr Liz
B. Liz Glu G. Gies Asp D. Asn ápr
6. Válaszd ki a helyes válaszokat.
Az aminosav gyökök között hidrogénkötések alakulhatnak ki:
A. Ser Gln B. Cis Tre
B. Asp Liz G. Glu Asp D. Asn Tre
7. Hozzon létre levelezést.
A fehérjeszerkezet kialakításában szerepet játszó kötés típusa:
A. Elsődleges szerkezet B. Másodlagos szerkezet
B. Harmadlagos szerkezet
D. Szuperszekunder szerkezet E. Konformáció.
1. Hidrogénkötések a peptidváz atomjai között
2. Gyenge kötések aminosavgyökök funkcionális csoportjai között
3. Az aminosavak α-amino- és α-karboxilcsoportjai közötti kapcsolatok
8. Válaszd ki a helyes válaszokat. Tripszin:
A. Proteolitikus enzim B. Két domént tartalmaz
B. Hidrolizálja a keményítőt
D. Az aktív központ a tartományok között található. D. Két polipeptidláncból áll.
9. Válaszd ki a helyes válaszokat. Atropin:
A. Neurotranszmitter
B. Az acetilkolin szerkezeti analógja
B. Kölcsönhatásba lép a H-kolinerg receptorokkal
D. Erősíti az idegimpulzusok vezetését a kolinerg szinapszisokon keresztül
D. M-kolinerg receptorok kompetitív inhibitora
10. Válassza ki a megfelelő állításokat. A fehérjékben:
A. Az elsődleges struktúra az aktív központjának szerkezetéről tartalmaz információkat
B. Az aktív központ az elsődleges szerkezet szintjén alakul ki
B. A konformációt kovalens kötések mereven rögzítik
D. Az aktív hely kölcsönhatásba léphet hasonló ligandumok csoportjával
a fehérjék D konformációs labilitása miatt. A környezet változásai befolyásolhatják az aktív fehérjék affinitását
központ a ligandum
1,1-C, 2-D, 3-B.
3.A, B, C, D.
7.1-B, 2-D, 3-A.
8.A, B, C, D.
ALAPVETŐ FELTÉTELEK ÉS FOGALMAK
1. Fehérje, polipeptid, aminosavak
2. Elsődleges, másodlagos, harmadlagos fehérjeszerkezet
3. Konformáció, natív fehérje konformáció
4. Kovalens és gyenge kötések egy fehérjében
5. Konformációs labilitás
6. A fehérje aktív központja
7. Ligandumok
8. Fehérje hajtogatás
9. A ligandumok szerkezeti analógjai
10. Domain fehérjék
11. Egyszerű és összetett fehérjék
12. Fehérjedenaturálás, denaturáló szerek
13. Fehérjék felújítása
Feladatokat megoldani
"A fehérjék szerkezeti szerveződése és működésük alapja"
1. A fehérje, a hemoglobin A (HbA) fő funkciója az oxigén szállítása a szövetekbe. Az emberi populációban ennek a fehérjének többféle, megváltozott tulajdonságokkal és funkcióval rendelkező formája ismert – az úgynevezett abnormális hemoglobinok. Például azt találták, hogy a sarlósejtes vérszegénységben (HbS) szenvedő betegek eritrocitáiban található hemoglobin S alacsony oldhatóságú alacsony oxigén parciális nyomás mellett (mint a vénás vérben). Ez a fehérje aggregátumainak kialakulásához vezet. A fehérje elveszti funkcióját, kicsapódik, a vörösvérsejtek szabálytalan alakot vesznek fel (egy részük sarlót alkot), és a lépben a szokásosnál gyorsabban pusztulnak el. Ennek eredményeként sarlósejtes vérszegénység alakul ki.
A HbA primer szerkezetében az egyetlen eltérést a hemoglobin β-láncának N-terminális régiójában találtuk. Hasonlítsa össze a β-lánc N-terminális végeit, és mutassa meg, hogy a fehérje elsődleges szerkezetében bekövetkező változások hogyan befolyásolják annak tulajdonságait és funkcióit.
 Ezért:
Ezért:
a) írja le azokat az aminosavképleteket, amelyekben a HBA különbözik, és hasonlítsa össze ezen aminosavak tulajdonságait (polaritás, töltés).
b) következtetést levonni a szöveti oldhatóság csökkenésének és az oxigéntranszport károsodásának okáról.
2. Az ábrán egy ligandumkötő hellyel (aktív hely) rendelkező fehérje szerkezetének diagramja látható. Magyarázza el, hogy egy fehérje miért szelektív a ligandum kiválasztásában. Ezért:
a) ne feledje, mi a fehérje aktív központja, és vegye figyelembe a fehérje aktív centrumának szerkezetét az ábrán;
b) írja fel az aktív centrumot alkotó aminosavgyökök képleteit!
c) rajzoljon egy ligandumot, amely specifikusan kölcsönhatásba léphet a fehérje aktív központjával. Jelölje fel azon funkciós csoportokat, amelyek képesek kötést kialakítani az aktív centrumot alkotó aminosavgyökökkel;
d) jelölje meg a ligandum és az aktív centrum aminosavgyökei között létrejövő kötések típusait;
e) magyarázza el, hogy a fehérje és a ligandum kölcsönhatásának specifitása min alapul.
 3.
Az ábrán a fehérje és számos ligandum aktív helye látható.
3.
Az ábrán a fehérje és számos ligandum aktív helye látható.
Határozza meg, hogy melyik ligandum lép a legnagyobb valószínűséggel kölcsönhatásba a fehérje aktív helyével, és miért.
 Milyen típusú kötések keletkeznek a fehérje-ligandum komplex kialakulása során?
Milyen típusú kötések keletkeznek a fehérje-ligandum komplex kialakulása során?
4. A természetes fehérje ligandumok szerkezeti analógjai gyógyszerként használhatók a fehérjék aktivitásának megváltoztatására.
Az acetilkolin a gerjesztés közvetítője a neuromuszkuláris szinapszisokban. Amikor az acetilkolin kölcsönhatásba lép a fehérjékkel - a vázizmok posztszinaptikus membránjának receptoraival, az ioncsatornák megnyílnak és az izmok összehúzódnak. A ditilin egy olyan gyógyszer, amelyet bizonyos izomlazító műtéteknél alkalmaznak, mivel megzavarja az idegimpulzusok átvitelét a neuromuszkuláris szinapszisokon keresztül. Ismertesse a ditilin, mint izomrelaxáns hatásmechanizmusát! Ezért:
a) írja le az acetilkolin és a ditilin képleteit, és hasonlítsa össze szerkezetüket;
b) ismertesse a ditilin relaxáló hatásának mechanizmusát!
5. Egyes betegségekben a páciens testhőmérséklete megemelkedik, amit a szervezet védekező reakciójának tekintenek. A magas hőmérséklet azonban káros a test fehérjéire. Magyarázza el, hogy 40 °C feletti hőmérsékleten miért zavar a fehérjék működése, és miért fenyegeti az emberi életet. Ehhez ne feledje:
1) A fehérjék szerkezete és a szerkezetét a natív konformációban tartó kötések;
2) Hogyan változik a fehérjék szerkezete és működése a hőmérséklet emelkedésével?;
3) Mi a homeosztázis és miért fontos az emberi egészség megőrzése szempontjából?
2. moduláris egység OLIGOMÉR FEHÉRJEK, MINT A SZABÁLYOZÁSI HATÁS CÉLJA. SZERKEZETI ÉS FUNKCIONÁLIS FEHÉRJEFAJTA. FEHÉRJÉVÁLASZTÁSI ÉS TISZTÍTÁSI MÓDSZEREK
Tanulási célok Ahhoz, hogy képes legyen:
1. Az oligomer fehérjék szerkezetének és funkcióinak sajátosságaira vonatkozó ismeretek felhasználása funkcióik szabályozásának adaptív mechanizmusainak megértéséhez.
2. Ismertesse a chaperonok szerepét a sejtkörülmények között a fehérjekonformáció szintézisében és fenntartásában.
3. Magyarázza meg az élet megnyilvánulásainak változatosságát a szervezetben szintetizálódó fehérjék felépítésének és funkcióinak változatosságával!
4. Elemezni a fehérjék szerkezete és működése közötti összefüggést rokon hemoproteinek - mioglobin és hemoglobin, valamint az immunglobulincsalád öt fehérjeosztályának képviselői - összehasonlításának példái segítségével.
5. Alkalmazza a fehérjék fiziko-kémiai tulajdonságainak sajátosságaira vonatkozó ismereteket más fehérjéktől és szennyeződésektől való tisztításukra.
6. A vérplazmafehérjék mennyiségi és minőségi összetételének eredményeinek értelmezése a klinikai diagnózis megerősítése vagy tisztázása érdekében.
Tud:
1. Az oligomer fehérjék szerkezetének jellemzői és funkcióik szabályozásának adaptív mechanizmusai a hemoglobin példáján.
2. A chaperonok szerkezete és funkciója, valamint szerepük a fehérjék natív konformációjának fenntartásában sejtkörülmények között.
3. A fehérjék konformációjuk és funkcióik hasonlósága szerinti családokba vonásának elvei immunglobulinok példáján.
4. Fehérjék elválasztási módszerei fizikai-kémiai tulajdonságaik sajátosságai alapján.
5. A vérplazma elektroforézise, mint a fehérjék minőségi és mennyiségi összetételének felmérésére szolgáló módszer.
TÉMAKÖR 1.4. AZ OLIGOMER FEHÉRJEK SZERKEZETÉNEK ÉS MŰKÖDÉSÉNEK JELLEMZŐI A HEMOGLOBIN PÉLDÁJÁN
1. Sok fehérje több polipeptid láncot tartalmaz. Az ilyen fehérjéket ún oligomer,és az egyes láncok - protomerek. Az oligomer fehérjékben lévő protomereket sok gyenge, nem kovalens kötés köti össze (hidrofób, ionos, hidrogén). Kölcsönhatás
protomerek köszönhetően valósul meg komplementaritásérintkezési felületeik.
Az oligomer fehérjékben a protomerek száma nagyon eltérő lehet: a hemoglobin 4, az aszpartát-aminotranszferáz enzim 12, a dohánymozaikvírus fehérje pedig 2120 nem kovalens kötéssel összekapcsolt protomert tartalmaz. Következésképpen az oligomer fehérjék nagyon nagy molekulatömegűek lehetnek.
Egy protomer kölcsönhatása másokkal egy fehérje ligandumokkal való kölcsönhatásának speciális esetének tekinthető, mivel minden protomer ligandumként szolgál más protomerek számára. A protomerek fehérjében való kombinálásának számát és módját ún kvaterner fehérjeszerkezet.
A fehérjék tartalmazhatnak azonos vagy eltérő szerkezetű protomereket, például a homodimerek két azonos protomert tartalmazó fehérjék, a heterodimerek pedig két különböző protomert tartalmazó fehérjék.
Ha a fehérjék különböző protomereket tartalmaznak, akkor különböző ligandumokkal rendelkező kötőhelyek eltérő szerkezete alakulhat ki rajtuk. Amikor a ligandum az aktív centrumhoz kötődik, ennek a fehérjének a funkciója megnyilvánul. A másik protomeren található központot allosztérikusnak nevezzük (az aktívtól eltérő). Kapcsolatfelvétel alloszterikus ligandum vagy effektor, szabályozó funkciót lát el (1.18. ábra). Az alloszterikus centrum kölcsönhatása az effektorral a teljes oligomer fehérje szerkezetében a konformációs labilitás miatt konformációs változásokat okoz. Ez befolyásolja az aktív hely affinitását egy specifikus ligandumhoz, és szabályozza ennek a fehérjének a működését. Az összes protomer konformációjában és működésében bekövetkező változást egy oligomer fehérje és legalább egy ligandum kölcsönhatása során kooperatív konformációs változásoknak nevezzük. A fehérje működését fokozó effektorokat ún aktivátorok,és a működését gátló effektorok - inhibitorok.
Így az oligomer fehérjék, valamint a doménszerkezetű fehérjék egy új tulajdonsággal rendelkeznek a monomer fehérjékhez képest - a funkciók alloszterikus szabályozásának képessége (szabályozás különböző ligandumok fehérjéhez való kapcsolásával). Ez látható két szorosan összefüggő komplex fehérje, a mioglobin és a hemoglobin szerkezetének és funkcióinak összehasonlításával.
 Rizs. 1.18. Dimer fehérje szerkezeti diagram
Rizs. 1.18. Dimer fehérje szerkezeti diagram
2. A térszerkezetek kialakulása és a mioglobin működése.
A mioglobin (MB) a vörös izmokban található fehérje, melynek fő funkciója az intenzív izommunkához szükséges O 2 tartalékok létrehozása. Az MB egy összetett fehérje, amely egy fehérjerészt - apoMv-t és egy nem fehérjerészt - hemet tartalmaz. Az apoMv elsődleges szerkezete határozza meg kompakt gömb alakú konformációját és az aktív hely szerkezetét, amelyhez a mioglobin nem fehérje része, a hem kapcsolódik. A vérből az izmokba érkező oxigén a mioglobin Fe + 2 heméhez kötődik. Az MB egy monomer fehérje, amely nagyon nagy O 2-affinitással rendelkezik, ezért a mioglobin oxigén felszabadulása csak intenzív izommunka során történik, amikor az O 2 parciális nyomása meredeken csökken.
Az MB konformáció kialakulása. A riboszómákon lévő vörös izmokban a transzláció során az MB elsődleges szerkezete szintetizálódik, amelyet egy 153 aminosavból álló specifikus szekvencia képvisel. Az MB másodlagos szerkezet nyolc α-hélixet tartalmaz, amelyeket latin betűknek neveznek A-tól H-ig, amelyek között nem-spirális szakaszok vannak. Az MB harmadlagos szerkezete tömör gömbölyű, melynek mélyülésében az F és az E α-hélix között aktív centrum található (1.19. ábra).
 Rizs. 1.19. A mioglobin szerkezete
Rizs. 1.19. A mioglobin szerkezete
3. A Мв aktív központ felépítésének és működésének jellemzői. Az MB aktív centrumát főleg hidrofób aminosav gyökök alkotják, amelyek az elsődleges szerkezetben egymástól távol helyezkednek el (pl. 3 9 és Fen 138) Az aktív centrumhoz vízben rosszul oldódó ligandumok - hem és O 2 - kapcsolódnak. A hem az apoMv specifikus liganduma (1.20. ábra), amely négy pirrolgyűrűn alapul, amelyeket metenil hidak kötnek össze; a Fe + 2 atom a központban helyezkedik el, négy koordinációs kötéssel kapcsolódik a pirrolgyűrűk nitrogénatomjaihoz. Az MB aktív centrumában a hidrofób aminosav gyökök mellett két aminosav aminosavmaradéka is található hidrofil gyökökkel - Gis E 7(Gis 64) és Az F8-asa(Gis 93) (1.21. ábra).
 Rizs. 1.20. A hem szerkezete a mioglobin és a hemoglobin nem fehérje része
Rizs. 1.20. A hem szerkezete a mioglobin és a hemoglobin nem fehérje része
 Rizs. 1.21. A hem és az O 2 elhelyezkedése az apomioglobin és a hemoglobin protomerek aktív központjában
Rizs. 1.21. A hem és az O 2 elhelyezkedése az apomioglobin és a hemoglobin protomerek aktív központjában
A hem egy vasatomon keresztül kovalensen kötődik His F 8-hoz. Az O 2 a hemsík másik oldalán lévő mirigyhez kapcsolódik. Az ő E 7 szükséges az O 2 helyes orientációjához, és elősegíti az oxigén hozzáadását a Fe + 2 hemhez
Az F8-asa koordinációs kötést képez Fe + 2-vel, és szilárdan rögzíti a hemet az aktív központban. Gis E 7 szükséges a helyes orientációhoz egy másik ligandum, az O 2 aktív központjában, amikor kölcsönhatásba lép a Fe + 2 hemével. A hem mikrokörnyezete megteremti a feltételeket az O 2 Fe + 2-vel való erős, de reverzibilis megkötéséhez, és megakadályozza a víz bejutását a hidrofób aktív centrumba, ami Fe + 3 -dá oxidációjához vezethet.
Az MB monomer szerkezete és aktív centruma meghatározza a fehérje O 2 iránti nagy affinitását.
4. A HB oligomer szerkezete és a HB O 2 ligandumokhoz való affinitásának szabályozása. Humán hemoglobinok- fehérjék családja, valamint a komplex fehérjékhez (hemoproteinekhez) kapcsolódó mioglobin. Tetramer szerkezetűek és két α-láncot tartalmaznak, de a másik két polipeptid lánc (2α-, 2x-láncok) szerkezetében különböznek. A második polipeptidlánc szerkezete meghatározza a HB ezen formáinak működési jellemzőit. A felnőtt vörösvértestek hemoglobinjának körülbelül 98%-a hemoglobin A(2α-, 2p-láncok).
Az intrauterin fejlődés időszakában a hemoglobinoknak két fő típusa van: embrionális HB(2α, 2ε), amely a magzati fejlődés korai szakaszában található, ill hemoglobin F (magzati)- (2α, 2γ), amely a méhen belüli fejlődés hatodik hónapjában pótolja a korai magzati hemoglobint, és csak születés után váltja fel a HB A.
A HB A a mioglobinnal (MB) rokon fehérje, és felnőttek eritrocitáiban található. Egyedi protomereinek szerkezete hasonló a mioglobinéhoz. A mioglobin és a hemoglobin protomerek másodlagos és harmadlagos szerkezete nagyon hasonló, annak ellenére, hogy polipeptid láncaik elsődleges szerkezetében mindössze 24 aminosav azonos (a hemoglobin protomereinek másodlagos szerkezete a mioglobinhoz hasonlóan nyolc α-hélixet tartalmaz, latin betűkkel jelöljük A-tól H -ig, és a harmadlagos szerkezet úgy néz ki, mint egy kompakt gömböcske). A mioglobintól eltérően azonban a hemoglobin oligomer szerkezetű, négy polipeptidláncból áll, amelyeket nem kovalens kötés köt össze (1.22. ábra).
Minden HB protomer egy nem fehérje részhez kapcsolódik – a hemhez és a szomszédos protomerekhez. A HB fehérje részének kapcsolódása a hemhez hasonló a mioglobinhoz: a fehérje aktív központjában a hem hidrofób részeit hidrofób aminosavgyökök veszik körül, a His F 8 és His E 7 kivételével. , amelyek a hem síkjának két oldalán helyezkednek el, és hasonló szerepet játszanak a fehérje működésében és oxigénnel való megkötésében (lásd a mioglobin szerkezetét).
 Rizs. 1.22. A hemoglobin oligomer szerkezete
Rizs. 1.22. A hemoglobin oligomer szerkezete
Ráadásul, Gis E 7 fontosnak tesz eleget további szerep az NV működésében. A szabad hem 25 000-szer nagyobb affinitást mutat a CO-hoz, mint az O 2-hez. A CO kis mennyiségben képződik a szervezetben, és a hem iránti nagy affinitása miatt megzavarhatja a sejtek életéhez szükséges O 2 szállítását. A hemoglobin összetételében azonban a hem szén-monoxidhoz való affinitása csak 200-szor haladja meg az O 2 affinitását, mivel az aktív centrumban van jelen a His E 7. Ennek az aminosavnak a fennmaradó része optimális feltételeket teremt ahhoz, hogy a hem kötődjön az O 2 -hoz, és gyengíti a hem és a CO kölcsönhatását.
5. A HB fő funkciója az O 2 szállítása a tüdőből a szövetekbe. Ellentétben a monomer mioglobinnal, amelynek nagyon nagy affinitása van az O 2 iránt, és az oxigén tárolási funkcióját tölti be a vörös izmokban, a hemoglobin oligomer szerkezete biztosítja:
1) a Hb gyors telítődése oxigénnel a tüdőben;
2) a HB azon képessége, hogy oxigént adjon a szövetekben viszonylag magas O 2 parciális nyomáson (20-40 Hgmm);
3) a HB O 2 affinitásának szabályozására való képesség.
6. A hemoglobin protomereinek konformációjában bekövetkező kooperatív változások felgyorsítják az O 2 megkötését a tüdőben és a szövetekbe való felszabadulását. A tüdőben az O 2 magas parciális nyomása elősegíti a HB-hez való kötődését négy protomer (2α és 2β) aktív központjában. Mindegyik protomer aktív központja, valamint a mioglobinban két α-hélix (F és E) között helyezkedik el egy hidrofób zsebben. Tartalmaz egy nem fehérje részt - hem, amely sok gyenge hidrofób kölcsönhatás révén kapcsolódik a fehérje részhez, valamint egy erős kötés a Fe 2 + hem és a His F 8 között (lásd 1.21. ábra).
A dezoxihemoglobinban ennek a His F 8-hoz való kötésnek köszönhetően a Fe 2 + atom a hem síkjából a hisztidin felé emelkedik ki. Az O 2 kötődése Fe 2 +-hoz a hem másik oldalán, a His E 7 tartományában, egyetlen szabad koordinációs kötés segítségével történik. A Gis E 7 optimális feltételeket biztosít az O 2 hemvashoz való kötődéséhez.
Az O 2 kapcsolódása az egyik protomer Fe +2 atomjához azt idézi elő, hogy az a hem síkjába kerül, majd a hozzá kötődő hisztidin maradék.
 Rizs. 1.23. A hemoglobin protomer konformációjának változása O 2 -vel való kombináció során
Rizs. 1.23. A hemoglobin protomer konformációjának változása O 2 -vel való kombináció során
Ez az összes polipeptidlánc konformációjának megváltozásához vezet a konformációs labilitásuk miatt. Más láncok konformációjának megváltoztatása megkönnyíti kölcsönhatásukat a következő O 2 molekulákkal.
A negyedik O 2 molekula 300-szor könnyebben kötődik a hemoglobinhoz, mint az első (1.24. ábra).
 Rizs. 1.24. A hemoglobin protomerek konformációjának kooperatív változásai az О 2-vel való kölcsönhatás során
Rizs. 1.24. A hemoglobin protomerek konformációjának kooperatív változásai az О 2-vel való kölcsönhatás során
A szövetekben minden következő O 2 molekula könnyebben hasad le, mint az előző, ami szintén a protomerek konformációjában bekövetkező kooperatív változások miatt következik be.
7. A szerves anyagok katabolizmusa során képződő CO 2 és H + koncentrációjuk arányában csökkenti a hemoglobin O 2 -hoz való affinitását. A sejtek működéséhez szükséges energia főként a mitokondriumokban termelődik a szerves anyagok oxidációja során, a tüdőből a hemoglobin által szállított O 2 felhasználásával. A szerves anyagok oxidációja következtében bomlásuk végtermékei keletkeznek: CO 2 és K 2 O, amelyek mennyisége arányos a folyamatban lévő oxidációs folyamatok intenzitásával.
CO 2 diffúzió a sejtekből a vérbe, és behatol az eritrocitákba, ahol a karbanhidráz enzim hatására szénsavvá alakul. Ez a gyenge sav protonná és bikarbonát-ionná disszociál.
H + képesek csatlakozni az Ő gyököihez 14 6 a hemoglobin α- és β-láncában, azaz. a hemtől távoli területeken. A hemoglobin protonálása csökkenti az O 2 iránti affinitását, elősegíti az O 2 kiürülését az oxiHb-ből, a dezoxiHb képződését, és a képződött protonok számával arányosan növeli a szövetek oxigénellátását (1.25. ábra).
A felszabaduló oxigén mennyiségének növekedését a vörösvértestekben a H + koncentrációjának növekedésétől függően Bohr-effektusnak nevezik (Christian Bohr dán fiziológus után, aki először fedezte fel ezt a hatást).
A tüdőben az oxigén nagy parciális nyomása elősegíti a dezoxi-HB-vel való kötődését, ami csökkenti a fehérje H + iránti affinitását. A karboanhidráz hatására felszabaduló protonok kölcsönhatásba lépnek a bikarbonátokkal, így СО 2 és Н 2 О keletkeznek.

 Rizs. 1.25. Az O 2 Hb-affinitása a CO 2 és a protonok koncentrációjától (Bohr-effektus):
Rizs. 1.25. Az O 2 Hb-affinitása a CO 2 és a protonok koncentrációjától (Bohr-effektus):
A- a CO 2 és H + koncentrációjának hatása az O 2 felszabadulására a HB komplexből (Bohr-effektus); B- a dezoxihemoglobin oxigenizációja a tüdőben, a CO 2 képződése és felszabadulása.
A keletkező CO 2 az alveoláris térbe kerül, és a kilélegzett levegővel távozik. Így a hemoglobin által a szövetekben felszabaduló oxigén mennyiségét a szerves anyagok lebontásának termékei szabályozzák: minél intenzívebb az anyagok lebomlása, például fizikai terhelés során, annál nagyobb a CO 2 és H + koncentrációja, és annál több. oxigént kapnak a szövetek a Hb O 2 -hez való affinitásának csökkenése következtében.
8. A Hb O 2 iránti affinitásának alloszterikus szabályozása a ligand - 2,3-bisz-foszfoglicerát által. Az eritrocitákban a hemoglobin alloszterikus ligandja, a 2,3-biszfoszfoglicerát (2,3-BFG) szintetizálódik a glükóz oxidációs termékéből, az 1,3-biszfoszfoglicerátból. Normál körülmények között a 2,3-BFG koncentrációja magas, és összehasonlítható a HB koncentrációjával. A 2,3-BFG erős negatív töltése -5.
 A szöveti kapillárisokban lévő biszfoszfoglicerát a dezoxihemoglobinhoz kötődve növeli az oxigén felszabadulását a szövetbe, csökkentve a HB O 2 iránti affinitását.
A szöveti kapillárisokban lévő biszfoszfoglicerát a dezoxihemoglobinhoz kötődve növeli az oxigén felszabadulását a szövetbe, csökkentve a HB O 2 iránti affinitását.
A tetramer hemoglobinmolekula közepén egy üreg található. Mind a négy protomer aminosav-maradékai alkotják (lásd 1.22. ábra). A szöveti kapillárisokban a HB protonálódása (Bohr-effektus) a hem vas és az O 2 közötti kötés megszakadásához vezet. Egy molekulában
dezoxihemoglobin, az oxihemoglobinhoz képest további ionos kötések keletkeznek, amelyek protomereket kapcsolnak össze, aminek következtében a központi üreg méretei megnőnek az oxihemoglobinhoz képest. A központi üreg az a hely, ahol a 2,3-BFG a hemoglobinhoz kötődik. A centrális üreg méretének különbsége miatt a 2,3-BFG csak a dezoxihemoglobinhoz tud kapcsolódni.
A 2,3-BFG kölcsönhatásba lép a hemoglobinnal a fehérje aktív központjaitól távoli régióban, és a allosztérikus(szabályozó) ligandumok, a HB központi ürege pedig az allosztérikus központ. A 2,3-BFG erős negatív töltésű, és kölcsönhatásba lép a HB két β-láncának öt pozitív töltésű csoportjával: az N-terminális Val α-aminocsoporttal és a Lys 82 His 143 gyökkel (1.26. ábra).
 Rizs. 1.26. BPH a dezoxihemoglobin központi üregében
Rizs. 1.26. BPH a dezoxihemoglobin központi üregében
A BPH minden β-láncban három pozitív töltésű csoporthoz kötődik.
A szöveti kapillárisokban a keletkező dezoxihemoglobin kölcsönhatásba lép a 2,3-BFG-vel, és a β-láncok pozitív töltésű gyökök és a negatív töltésű ligandum között ionos kötések jönnek létre, amelyek megváltoztatják a fehérje konformációját és csökkentik a HB affinitását O 2. A Hb O 2 iránti affinitásának csökkenése hozzájárul az O 2 hatékonyabb felszabadulásához a szövetbe.
A tüdőben nagy parciális nyomáson az oxigén kölcsönhatásba lép a HB-vel, és a hemvashoz kötődik; ugyanakkor a fehérje konformációja megváltozik, a központi üreg csökken, és a 2,3-BFG kiszorul az allosztérikus centrumból
Így az oligomer fehérjék új tulajdonságokkal rendelkeznek a monomer fehérjékhez képest. A ligandumok rögzítése a helyeken
egymástól térben távol (allosztérikus), képesek a teljes fehérjemolekulában konformációs változásokat okozni. A szabályozó ligandumokkal való kölcsönhatás következtében a konformáció megváltozik, a fehérjemolekula funkciója alkalmazkodik a környezet változásaihoz.
TÉMAKÖR 1.5. A NATÍV FEHÉRJEKONFORMÁCIÓ FENNTARTÁSA SEJTEK KÖRÜLMÉNYEK ALATT
A sejtekben a polipeptid láncok szintézise során a membránokon keresztül a sejt megfelelő szakaszaiba, a folding során (natív konformáció kialakulása) és az oligomer fehérjék összeállítása során, valamint működésük során, közbenső, hajlamos. az aggregációhoz instabil konformációk jelennek meg a fehérjék szerkezetében. A hidrofób gyökök, amelyek a natív konformációban általában egy fehérjemolekulában rejtőznek, instabil konformációban találják magukat a felszínen, és hajlamosak más fehérjék ugyanazokkal a vízben rosszul oldódó csoportjaival kombinálódni. Valamennyi ismert élőlény sejtjében találtak olyan speciális fehérjéket, amelyek biztosítják a sejtfehérjék optimális feltekeredését, működés közben stabilizálják natív konformációjukat, és ami különösen fontos, homeosztázis zavar esetén fenntartják az intracelluláris fehérjék szerkezetét és működését. Ezeket a fehérjéket elnevezték "kísérők", ami franciául „dada”-t jelent.
1. Molekuláris chaperonok és szerepük a fehérjedenaturáció megelőzésében.
A chaperonokat (III) alegységtömeg szerint osztályozzuk. A nagy molekulatömegű chaperonok tömege 60-110 kDa. Közülük három osztály a leginkább tanulmányozott: Sh-60, Sh-70 és Sh-90. Minden osztály tartalmaz egy rokon fehérjecsaládot. Tehát a III-70 összetétele 66-78 kDa molekulatömegű fehérjéket tartalmaz. Az alacsony molekulatömegű chaperonok molekulatömege 40-15 kDa.
A kísérők között megkülönböztetjük alkotó fehérjék, amelyek magas szintű alapszintézise nem függ a szervezet sejtjeit érő stresszhatásoktól, és indukálható, amelyek szintézise normál körülmények között gyenge, de stressz hatására meredeken megnövekszik. Az indukálható chaperonokat "hősokk-fehérjéknek" is nevezik, mivel először magas hőmérsékletnek kitett sejtekben fedezték fel őket. A sejtekben a magas fehérjekoncentráció miatt a részben denaturált fehérjék spontán megújulása nehézkes. A III-70 megakadályozhatja a kezdődő denaturációs folyamatot, és elősegítheti a fehérjék natív konformációjának helyreállítását. Molekuláris chaperonok-70- a fehérjék erősen konzervált osztálya, amely a sejt minden részében megtalálható: citoplazmában, sejtmagban, endoplazmatikus retikulumban, mitokondriumokban. Az egyetlen III-70 polipeptid lánc karboxil végén van egy olyan régió, amely egy barázda, amely képes kölcsönhatásba lépni hosszúságú peptidekkel.
7-9 aminosavból, hidrofób gyökökben dúsítva. Az ilyen régiók a globuláris fehérjékben körülbelül minden 16 aminosavban előfordulnak. A III-70 képes megvédeni a fehérjéket a hőmérsékleti inaktivációtól, és helyreállítani a részlegesen denaturált fehérjék konformációját és aktivitását.
2. A chaperonok szerepe a fehérje feltekeredésében. Amikor fehérjéket szintetizálnak a riboszómán, a polipeptid N-terminális régiója korábban szintetizálódik, mint a C-terminális régió. A fehérje teljes aminosav-szekvenciája szükséges a natív konformáció kialakításához. A fehérjeszintézis folyamatában a chaperon-70 az aktív centrum szerkezetéből adódóan képes lezárni a hidrofób aminosavgyökökkel dúsított polipeptid aggregációra hajlamos régióit, amíg a szintézis be nem fejeződik (1.27. ábra, A).
 Rizs. 1.27. Chaperonok részvétele a fehérje hajtogatásban
Rizs. 1.27. Chaperonok részvétele a fehérje hajtogatásban
A - chaperon-70 részvétele a szintetizált polipeptid régiói közötti hidrofób kölcsönhatások megelőzésében; B - natív fehérje konformáció kialakulása a chaperon komplexben
Sok nagy molekulatömegű, összetett konformációjú fehérje, például doménszerkezettel, a III-60 által alkotott speciális térben hajtódik össze. Sh-60 14 alegységből álló oligomer komplexként működik. Két üreges gyűrűt alkotnak, amelyek mindegyike hét alegységből áll, ezek a gyűrűk kapcsolódnak egymáshoz. Mindegyik III-60 alegység három doménből áll: apikális (apikális), hidrofób gyökökben dúsított, a gyűrű üregével szemben, intermedier és ekvatoriális (1.28. ábra).
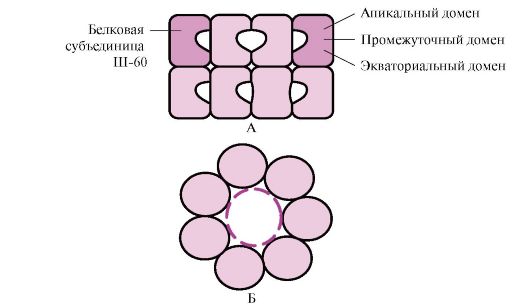 Rizs. 1.28. A chaperonin komplex szerkezete, amely 14 Sh-60-ból áll
Rizs. 1.28. A chaperonin komplex szerkezete, amely 14 Sh-60-ból áll
A - oldalnézet; B - felülnézet
A szintetizált fehérjék, amelyek felületén a kibontott molekulákra jellemző elemek, különösen a hidrofób gyökök vannak, bejutnak a chaperongyűrűk üregébe. Ezeknek az üregeknek a sajátos környezetében a lehetséges konformációk számbavétele történik addig, amíg meg nem találjuk az egyetlen, energetikailag legkedvezőbbet (1.27. ábra, B). A konformációk kialakulását és a fehérje felszabadulását az ATP hidrolízise kíséri az ekvatoriális régióban. Jellemzően az ilyen chaperone-függő hajtogatás jelentős mennyiségű energiát igényel.
Amellett, hogy részt vesznek a fehérjék háromdimenziós szerkezetének kialakításában és a részben denaturált fehérjék újraélesztésében, a chaperonokra olyan alapvető folyamatokhoz is szükség van, mint az oligomer fehérjék összeállítása, a denaturált fehérjék felismerése és szállítása a lizoszómákba, fehérjék szállítása. a membránokon keresztül, és részt vesz a fehérjekomplexek aktivitásának szabályozásában.
TÉMAKÖR 1.6. VÁLTOZATOS FEHÉRJÉK. FEHÉRJECSALÁDOK IMUNOGLOBULINOK PÉLDÁJÁN
1. A fehérjék az egyes sejtek és az egész többsejtű szervezet életében meghatározó szerepet töltenek be, funkciójuk pedig meglepően sokrétű. Ezt a fehérjék elsődleges szerkezetének és konformációinak sajátosságai, az aktív centrum szerkezetének egyedisége, valamint a specifikus ligandumokhoz való kötődési képesség határozzák meg.
A peptidláncok összes lehetséges változatának csak nagyon kis része tud stabil térbeli szerkezetet felvenni; többség
ezek közül sok konformációt vehet fel megközelítőleg azonos Gibbs-energiával, de eltérő tulajdonságokkal. A legtöbb ismert fehérje biológiai evolúcióval kiválasztott elsődleges szerkezete kivételes stabilitást biztosít az egyik konformációnak, amely meghatározza e fehérje működésének sajátosságait.
2. Fehérjék családjai. Ugyanazon biológiai fajon belül az aminosavak szubsztitúciói különböző fehérjék megjelenéséhez vezethetnek, amelyek rokon funkciókat látnak el, és homológ aminosavszekvenciákkal rendelkeznek. Az ilyen rokon fehérjék feltűnően hasonló konformációkkal rendelkeznek: az α-hélixek és/vagy β-struktúrák száma és interpozíciója, a polipeptidláncok legtöbb fordulata és hajlata hasonló vagy azonos. A polipeptidlánc homológ régióit, hasonló konformációt és kapcsolódó funkciókat tartalmazó fehérjéket fehérjecsaládokba izolálják. Példák fehérjecsaládokra: szerin proteinázok, immunglobulin család, mioglobin család.
Szerin proteinázok- fehérjecsalád, amely proteolitikus enzimek funkcióját látja el. Ide tartoznak az emésztőenzimek – kimotripszin, tripszin, elasztáz és számos véralvadási faktor. Ezek a fehérjék a pozíciók 40%-ában azonos aminosavakat tartalmaznak, és nagyon szoros a konformáció (1.29. ábra).

Rizs. 1.29. Az elasztáz (A) és a kimotripszin (B) térbeli szerkezete
Néhány aminosav-szubsztitúció ezen fehérjék szubsztrátspecifitásának megváltozásához és a családon belüli funkcionális diverzitás kialakulásához vezetett.
3. Az immunglobulinok családja. A három fehérjecsaládot magában foglaló immunglobulin szupercsalád fehérjéi óriási szerepet játszanak az immunrendszer működésében:
antitestek (immunglobulinok);
T-limfocita receptorok;
A fő hisztokompatibilitási komplex fehérjéi - MHC 1. és 2. osztály (Major Histocompatibility Complex).
Mindezek a fehérjék doménszerkezettel rendelkeznek, homológ immunszerű doménekből állnak, és hasonló funkciókat látnak el: kölcsönhatásba lépnek idegen struktúrákkal, akár a vérben, a nyirokban vagy az intercelluláris folyadékban (antitestek), akár a sejtek felszínén (saját) találhatók. vagy külföldi).
4. Antitestek- a B-limfociták által termelt specifikus fehérjék egy idegen struktúra szervezetbe jutására válaszul, ún antigén.
Az antitestek szerkezetének jellemzői
A legegyszerűbb antitestmolekulák négy polipeptid láncból állnak: két azonos könnyű - L, amely körülbelül 220 aminosavat tartalmaz, és két azonos nehéz - H, amely 440-700 aminosavból áll. Az antitestmolekulában mind a négy láncot sok nem kovalens kötés és négy diszulfidkötés köti össze (1.30. ábra).
Az antitest könnyű láncai két doménből állnak: variábilis (VL), amely a polipeptidlánc N-terminális régiójában található, és konstans (CL), amely a C-terminálison található. A nehézláncoknak általában négy doménje van: egy változó (VH) az N-terminálison, és három konstans (CH1, CH2, CH3) (lásd 1.30. ábra). Mindegyik immunglobulin doménnek van egy β-lemez szuperstruktúrája, amelyben két ciszteinmaradékot diszulfidkötés köt össze.
A két konstans CH1 és CH2 domén között van egy nagyszámú prolinmaradékot tartalmazó régió, amely megakadályozza a másodlagos szerkezet kialakulását és a szomszédos H láncok kölcsönhatását ebben a szegmensben. Ez a csuklórégió rugalmasságot biztosít az antitestmolekula számára. A nehéz és könnyű lánc variábilis doménje között két azonos antigénkötő hely (aktív antigénkötő hely) található, ezért az ilyen antitesteket gyakran ún. bivalensek. Az antigén antitesthez való kötődésében nem mindkét lánc variábilis régióinak teljes aminosavszekvenciája vesz részt, hanem csak 20-30 aminosav, amely az egyes láncok hipervariábilis régióiban található. Ezek a régiók határozzák meg az egyes típusú antitestek egyedi képességét a megfelelő komplementer antigénnel való kölcsönhatásra.
Az antitestek a szervezet védekezésének egyik vonalát jelentik a behatoló idegen organizmusok ellen. Működésük két szakaszra osztható: az első szakasz az antigén felismerése és megkötése idegen organizmusok felszínén, ami az antitest szerkezetében található antigénkötő helyek miatt lehetséges; a második szakasz az antigén inaktiválási és elpusztítási folyamatának beindítása. A második szakasz specifitása az antitestek osztályától függ. A nehéz láncoknak öt osztálya különbözik egymástól a konstans domének szerkezetében: α, δ, ε, γ és μ, amelyek szerint az immunglobulinok öt osztályát különböztetjük meg: A, D, E, G és M. .
A nehéz láncok szerkezeti jellemzői az egyes osztályokra jellemző konformációt adnak a nehéz láncok csuklórégióinak és C-terminális régióinak. Az antigén antitesthez való kötődése után az állandó domének konformációs változásai határozzák meg az antigén eltávolításának útvonalát.
 Rizs. 1.30 Az IgG doménszerkezete
Rizs. 1.30 Az IgG doménszerkezete
Immunglobulinok M
Az M immunglobulinoknak két formája van.
Monomer forma- A fejlődő B-limfocita által termelt antitestek 1. osztálya. Ezt követően sok B-sejt más osztályú antitestek termelésére tér át, de ugyanazzal az antigénkötő hellyel. Az IgM beépül a membránba, és antigénfelismerő receptorként működik. Az IgM sejtmembránba való beépülése a régió farokrészében 25 hidrofób aminosav jelenléte miatt lehetséges.
Az IgM szekréciós formájaöt monomer alegységet tartalmaz, amelyek diszulfidkötéssel kapcsolódnak egymáshoz, és egy további polipeptid J-láncot (1.31. ábra). Az ilyen formájú monomerek nehéz láncai nem tartalmaznak hidrofób farkot. A pentamernek 10 antigénkötő helye van, ezért hatékonyan felismeri és eltávolítja a szervezetbe először bekerült antigént. Az IgM szekréciós formája az elsődleges immunválasz során a véráramba szekretált antitestek fő osztálya. Az IgM antigénhez való kötődése megváltoztatja az IgM konformációját, és indukálja kötődését a komplementrendszer első fehérjekomponenséhez (a komplementrendszer az antigén elpusztításában részt vevő fehérjék halmaza), és aktiválja ezt a rendszert. Ha az antigén a mikroorganizmus felszínén található, a komplementrendszer a sejtmembrán integritásának megsértését és a baktériumsejt halálát okozza.
Immunglobulinok G
Mennyiségi értelemben az immunglobulinok ezen osztálya dominál a vérben (az összes Ig 75%-a). IgG – monomerek, az antitestek fő osztálya, amelyek egy másodlagos immunválasz során kiválasztódnak a véráramba. Az IgG és a mikroorganizmusok felszíni antigénjei közötti kölcsönhatás után az antigén-antitest komplex képes megkötni és aktiválni a komplement rendszer fehérjéit, vagy kölcsönhatásba léphet a makrofágok és neutrofilek specifikus receptoraival. A fagocitákkal való kölcsönhatás vezet
 Rizs. 1.31. Az IgM szekréciós formájának szerkezete
Rizs. 1.31. Az IgM szekréciós formájának szerkezete
az antigén-antitest komplexek felszívódásához és a sejtek fagoszómáiban való elpusztításához. Az IgG az egyetlen olyan antitestcsoport, amely képes átjutni a placenta gáton, és méhen belüli védelmet nyújt a magzat számára a fertőzésekkel szemben.
Immunglobulinok A
A váladékban (tej, nyál, légúti és bélváladék) jelenlévő antitestek fő osztálya. Az IgA főként dimer formában szekretálódik, ahol a monomerek egy további J-láncon keresztül kapcsolódnak egymáshoz (1.32. ábra).
Az IgA nem lép kölcsönhatásba a komplementrendszerrel és a fagocita sejtekkel, de a mikroorganizmusokhoz kötődve az antitestek megakadályozzák a hámsejtekhez való kötődésüket és a szervezetbe való behatolásukat.
Immunglobulinok E
Az E immunglobulinokat olyan monomerek képviselik, amelyekben a nehéz ε-láncok az M immunglobulinok μ-láncaihoz hasonlóan egy variábilis és négy konstans domént tartalmaznak. Az IgE a szekréció után kötődik
 Rizs. 1.32. IgA szerkezet
Rizs. 1.32. IgA szerkezet
C-terminális helyek megfelelő receptorokkal a hízósejtek és a bazofilek felszínén. Ennek eredményeként ezek a sejtek felületén antigének receptoraivá válnak (1.33. ábra).
 Rizs. 1.33. Az IgE és az antigén kölcsönhatása a hízósejt felszínén
Rizs. 1.33. Az IgE és az antigén kölcsönhatása a hízósejt felszínén
Miután az antigén az IgE megfelelő antigénkötő helyeihez kötődik, a sejtek jelet kapnak a biológiailag aktív anyagok (hisztamin, szerotonin) szekréciójáról, amelyek nagymértékben felelősek a gyulladásos reakciók kialakulásáért és az allergiás reakciók megjelenéséért. mint az asztma, csalánkiütés és szénanátha.
Immunglobulinok D
A D immunglobulinok nagyon kis mennyiségben találhatók a szérumban; ezek monomerek. A nehéz δ-láncoknak egy változó és három konstans tartományuk van. Az IgD a B-limfociták receptoraként működik, egyéb funkciói még nem ismertek. A specifikus antigének kölcsönhatása a B-limfociták (IgD) felszínén lévő receptorokkal ezeknek a jeleknek a sejtbe történő átviteléhez és olyan mechanizmusok aktiválásához vezet, amelyek biztosítják a limfociták klónjának szaporodását.
TÉMAKÖR 1.7. A FEHÉRJÉK FIZIKAI ÉS KÉMIAI TULAJDONSÁGAI ÉS ELVÁLASZTÁSUK MÓDSZEREI
1. Az egyes fehérjék fizikai és kémiai tulajdonságaikban különböznek egymástól:
A molekulák alakja;
Molekuláris tömeg;
A teljes töltés, amelynek értéke az aminosavak anionos és kationos csoportjainak arányától függ;
A poláris és a nem poláris aminosav gyökök aránya a molekulák felületén;
A különböző denaturáló szerek hatásával szembeni ellenállás mértéke.
2. A fehérjék oldhatósága attól függ a fent felsorolt fehérjék tulajdonságairól, valamint a fehérjét feloldó közeg összetételéről (pH-érték, sóösszetétel, hőmérséklet, egyéb, a fehérjével kölcsönhatásba lépő szerves anyagok jelenléte). A fehérjemolekulák töltésének nagysága az egyik olyan tényező, amely befolyásolja oldhatóságukat. Az izoelektromos pont töltésvesztésével a fehérjék könnyebben aggregálódnak és kicsapódnak. Ez különösen igaz a denaturált fehérjékre, amelyek felületén hidrofób aminosavgyökök találhatók.
A fehérjemolekula felületén pozitív és negatív töltésű aminosavgyökök egyaránt találhatók. Ezeknek a csoportoknak a száma, és így a fehérjék teljes töltése a táptalaj pH-jától függ, pl. a H + - és OH - -csoportok koncentrációjának aránya. Savas környezetben a H + koncentrációjának növekedése a -COO - + H +> - COOH karboxilcsoportok disszociációjának elnyomásához és a fehérjék negatív töltésének csökkenéséhez vezet. Lúgos közegben az -NH 3 + + OH - - NH 2 + H 2 O aminocsoportok víz képződésével történő disszociációja során keletkező protonok OH-feleslegének megkötése a fehérjék pozitív töltésének csökkenéséhez vezet. Azt a pH-értéket, amelynél a fehérje teljes nulla töltése van, nevezzük izoelektromos pont (IEP). Az IEP-ben a pozitív és negatív töltésű csoportok száma azonos, i.e. a fehérje izoelektromos állapotban van.
3. Az egyes fehérjék szétválasztása. A test szerkezetének és működésének jellemzői a benne szintetizált fehérjék halmazától függenek. A fehérjék szerkezetének és tulajdonságainak tanulmányozása lehetetlen a sejtből való izolálásuk és más fehérjéktől és szerves molekuláktól való tisztítás nélkül. Az egyes fehérjék izolálásának és tisztításának szakaszai:
Sejtpusztulás a vizsgált szövetből, és homogenizátumot kapunk.
A homogenizátum szétválasztása frakciókra centrifugálással a kívánt fehérjét tartalmazó nukleáris, mitokondriális, citoszolos vagy más frakciót nyerünk.
Szelektív hődenaturáció- a fehérjeoldat rövid távú melegítése, amely során lehetőség van a denaturált fehérje szennyeződések egy részének eltávolítására (amennyiben a fehérje viszonylag hőstabil).
Kisózni. A különböző fehérjék különböző sókoncentrációkkal válnak ki az oldatban. A sókoncentráció fokozatos növelésével számos olyan egyedi frakciót lehet előállítani, amelyek közül az egyikben túlnyomórészt a szekretált fehérje van. A fehérje frakcionálására leggyakrabban az ammónium-szulfátot használják. A legalacsonyabb oldhatóságú fehérjék alacsony sókoncentráció esetén kicsapódnak.
Gélszűrés- Molekulák szitálásának módszere duzzadt Sephadex granulátumokon (háromdimenziós poliszacharid dextrán láncok pórusokkal). A fehérjék Sephadex-szel töltött oszlopon való áthaladásának sebessége a molekulatömegüktől függ: minél kisebb a fehérjemolekulák tömege, annál könnyebben hatolnak be a szemcsékbe, és annál hosszabb ideig maradnak ott, minél nagyobb a tömegük, annál gyorsabban eluálódnak a szemcsékből. oszlop.
Ultracentrifugálás- olyan módszer, amelyben a centrifugacsőben lévő fehérjéket ultracentrifuga rotorba helyezik. Amikor a rotor forog, a fehérjék ülepedési sebessége arányos molekulatömegükkel: a nehezebb fehérjék frakciói közelebb helyezkednek el a kémcső aljához, a könnyebbek a felszínhez.
Elektroforézis- a fehérjék elektromos térben való mozgási sebességének különbségén alapuló módszer. Ez az érték arányos a fehérjék töltésével. A fehérje elektroforézist papíron (ebben az esetben a fehérjék mozgási sebessége csak töltésükkel arányos) vagy bizonyos pórusméretű poliakrilamid gélben (a fehérjék mozgási sebessége arányos töltésükkel és molekulatömegükkel) végezzük. .
Ioncserélő kromatográfia- olyan frakcionálási módszer, amely a fehérjék ionizált csoportjainak ioncserélő gyanta (oldhatatlan polimer anyagok) ellentétes töltésű csoportjaihoz történő megkötésén alapul. A fehérje gyantához való kötődésének erőssége arányos a fehérje töltésével. Az ioncserélő polimeren adszorbeált fehérjék növekvő koncentrációjú NaCl oldatokkal moshatók le; minél kisebb a fehérje töltése, annál kisebb NaCl koncentrációra lesz szükség a gyanta ionos csoportjaihoz kötött fehérje lemosásához.
Affinitáskromatográfia- a legspecifikusabb módszer az egyes fehérjék izolálására Egy fehérje liganduma kovalensen kapcsolódik egy inert polimerhez. Ha a fehérjék oldatát egy polimerrel ellátott oszlopon vezetjük át a fehérje ligandumhoz való komplementer kötődése miatt, csak az adott ligandumra specifikus fehérje adszorbeálódik az oszlopon.
Dialízis- kis molekulatömegű vegyületek eltávolítására szolgáló módszer az izolált fehérje oldatából. A módszer azon alapul, hogy a fehérjék nem tudnak átjutni egy féligáteresztő membránon, ellentétben a kis molekulatömegű anyagokkal. Fehérjék tisztítására használják kis molekulatömegű szennyeződésektől, például sóktól a kisózást követően.
AZ ELLENŐRZÉSEN KÍVÜLI MUNKA CÉLJAI
1. Töltse ki a táblázatot. 1.4.
1.4. táblázat. A rokon fehérjék - mioglobin és hemoglobin - szerkezetének és funkcióinak összehasonlító elemzése
a) emlékezzünk az MB és a Hb aktív központ szerkezetére. Mi a hidrofób aminosavgyökök szerepe ezen fehérjék aktív centrumainak kialakításában? Ismertesse az MB és Hb aktív centrum felépítését és a ligandumokhoz való kötődés mechanizmusait! Mi a szerepe a His F 8 és His E 7 maradékoknak az MB és Hv aktív központ működésében?
b) milyen új tulajdonságokkal rendelkezik a monomer mioglobinhoz képest egy közeli rokon oligomer fehérje, a hemoglobin? Ismertesse a kooperatív változások szerepét a hemoglobin molekulában lévő protomerek konformációjában, a CO2 és protonkoncentrációk hatását a hemoglobin oxigénaffinitására, valamint a 2,3-BPH szerepét a Hb funkció alloszterikus szabályozásában.
2. Jellemezze a molekuláris chaperonokat, ügyelve szerkezetük és működésük kapcsolatára!
3. Milyen fehérjéket sorolunk családokba? Példaként az immunglobulincsaládot használva határozza meg e család fehérjéinek hasonló szerkezeti jellemzőit és kapcsolódó funkcióit.
4. Biokémiai és orvosi célokra gyakran van szükség tisztított egyedi fehérjékre. Ismertesse a fehérjék fiziko-kémiai tulajdonságaival kapcsolatos elválasztási és tisztítási módszereket!
ÖNIRÁNYÍTÁSI FELADATOK
1. Válaszd ki a helyes válaszokat.
A hemoglobin funkciói:
A. O 2 szállítása a tüdőből a szövetekbe B. H + szállítása a szövetekből a tüdőbe
B. A vér állandó pH-értékének fenntartása D. A CO 2 transzportja a tüdőből a szövetbe
E. CO 2 szállítása a szövetekből a tüdőbe
2. Válaszd ki a helyes válaszokat. Ligandα - HB protomer: A. Heme
B. Oxigén
B. CO G. 2,3-BFG
E. β-protomer
3. Válaszd ki a helyes válaszokat.
Hemoglobin a mioglobinnal szemben:
A. Kvaterner szerkezetű
B. A másodlagos szerkezetet csak α-hélixek ábrázolják
B. Komplex fehérjékre utal
D. Kölcsönhatásba lép egy allosztérikus ligandummal D. Kovalens kötéssel kapcsolódik a hemhez
4. Válaszd ki a helyes válaszokat.
A Нв О 2 affinitása csökken:
A. Egy O 2 molekula hozzáadásával B. Egy O 2 molekula eliminálásával
B. Amikor kölcsönhatásba lép a 2,3-BFG-vel
D. H + D protomerekhez kapcsolva. A 2,3-BFG koncentrációjának csökkenésével
5. Hozzon létre levelezést.
A HB típusokra jellemző:
A. Dezoxi formában fibrilláris aggregátumokat képez B. Két α- és két δ-láncot tartalmaz
B. A HB domináns formája a felnőttek eritrocitáiban D. Az aktív központban hem található Fe + 3-mal
E. Két α- és két γ-láncot tartalmaz 1. НвА 2.
6. Hozzon létre levelezést.
HB ligandumok:
A. HB-hez kötődik az allosztérikus központban
B. Nagyon nagy affinitása van a HB aktív központhoz
B. Az összekapcsolás növeli a Hb affinitását az O 2 G iránt. A Fe + 2 -t Fe + 3 -dá oxidálja
E. Kovalens kötést képez a hisF8-cal
7. Válaszd ki a helyes válaszokat.
Kísérők:
A. A sejt minden részében jelenlévő fehérjék
B. A szintézist fokozza a stressz
B. Részt vesz a denaturált fehérjék hidrolízisében
D. Részvétel a fehérjék natív konformációjának fenntartásában
E. Hozzon létre olyan organellumokat, amelyekben fehérje konformáció képződik
8. Állítsa be a megfelelést. Immunglobulinok:
A. A kiválasztó forma pentamer
B. Ig osztály, áthatol a placenta gáton
B. Ig - hízósejt receptor
D. Az Ig fő osztálya, jelen van a hámsejtek váladékában. E. B-limfocita receptor, melynek aktiválása biztosítja a sejtszaporodást
9. Válaszd ki a helyes válaszokat.
Immunglobulinok E:
A. Makrofágok termelik B. Nehéz ε-láncokkal rendelkeznek.
B. Beépülnek a T-limfociták membránjába
D. Játssza el a membránreceptorok szerepét a hízósejteken és a bazofileken lévő antigénekre
E. Felelős az allergiás reakciók megnyilvánulásáért
10. Válaszd ki a helyes válaszokat.
A fehérjék szétválasztásának módszere molekulatömegük különbségén alapul:
A. Gélszűrés
B. Ultracentrifugálás
B. Poliakrilamid gélelektroforézis D. Ioncserélő kromatográfia
D. Affinitáskromatográfia
11. Válaszd ki a megfelelő választ.
A fehérjék elválasztásának módszere a vízben való oldhatóságuk különbségén alapul:
A. Gélszűrés B. Kisózás
B. Ioncserélő kromatográfia D. Affinitáskromatográfia
D. Poliakrilamid gélelektroforézis
AZ „ÖNIRÁNYÍTÁSI FELADATOK” SZABVÁLASZAI
1.A, B, C, D
2.A, B, C, D
5.1-B, 2-A, 3-D
6.1-B, 2-B, 3-A
7.A, B, D, D
8,1-D; 2-B, 3-C
ALAPVETŐ FELTÉTELEK ÉS FOGALMAK
1. Oligomer fehérjék, protomerek, fehérjék kvaterner szerkezete
2. Kooperatív változások a protomerek konformációjában
3. Bohr-effektus
4. Fehérjefunkciók alloszterikus szabályozása, alloszterikus centrum és alloszterikus effektor
5. Molekuláris chaperonok, hősokk fehérjék
6. Fehérjecsaládok (szerin proteázok, immunglobulinok)
7. A szerkezet IgM-, G-, E-, A-kapcsolata a funkcióval
8. Fehérjék teljes töltése, fehérjék izoelektromos pontja
9. Elektroforézis
10. Kisózni
11. Gélszűrés
12. Ioncserélő kromatográfia
13. Ultracentrifugálás
14. Affinitáskromatográfia
15. Vérplazmafehérjék elektroforézise
A MUNKA ELLENŐRZÉSI FELADATAI
1. Hasonlítsa össze a hemoglobin (Hb) és a mioglobin (Mb) oxigéntel való telítési fokának a szövetekben fennálló parciális nyomásától való függését
 Rizs. 1.34. Мв telítettségfüggése ésHboxigént a parciális nyomásából
Rizs. 1.34. Мв telítettségfüggése ésHboxigént a parciális nyomásából
Vegye figyelembe, hogy a fehérjék oxigéntelítettségi görbéinek alakja eltérő: mioglobinnál - hiperbola, hemoglobinnál - szigma alakú.
1. Hasonlítsa össze az oxigén parciális nyomásának értékeit, amelynél az MB és a HB 50%-ban telített O 2 -vel. Az alábbi fehérjék közül melyiknek van nagyobb affinitása az O 2 iránt?
2. Milyen szerkezeti jellemzők határozzák meg az MB О 2 iránti nagy affinitását?
3. Milyen szerkezeti jellemzői teszik lehetővé a HB-nek, hogy a nyugalmi szövetek kapillárisaiban O 2-t adjon le (viszonylag magas O 2 parciális nyomás mellett), és ezt a visszatérést jelentősen megnövelje a dolgozó izmokban? Az oligomer fehérjék milyen tulajdonsága biztosítja ezt a hatást?
4.Számítsa ki, mekkora mennyiségű O 2 (%-ban) ad oxigénnel dúsított hemoglobint egy pihenő és dolgozó izomnak?
5. vonjon le következtetéseket a fehérje szerkezete és funkciója közötti összefüggésre vonatkozóan.
2. A hemoglobin által a kapillárisokban felszabaduló oxigén mennyisége a szövetekben zajló katabolikus folyamatok intenzitásától függ (Bohr-effektus). Hogyan szabályozzák a szöveti anyagcsere változásai a Hb O 2 iránti affinitását? A CO 2 és a H + hatása a Hb O 2 iránti affinitására
 1. Ismertesse a Bohr-effektust!
1. Ismertesse a Bohr-effektust!
2. melyik irányba mutat a folyamat az ábrán:
a) a tüdő kapillárisaiban;
b) szöveti kapillárisokban?
3. Mi a Bohr-effektus élettani jelentősége?
4. Miért változtatja meg a Hb és a H + kölcsönhatása a hemtől távoli helyeken a fehérje O 2 iránti affinitását?
3. A Hb O 2 affinitása ligandjának, a 2,3-biszfoszfoglicerátnak a koncentrációjától függ, amely a Hb O 2 affinitásának alloszterikus szabályozója. Miért befolyásolja a fehérje működését a ligandum kölcsönhatása az aktív helytől távoli helyen? Hogyan szabályozza a 2,3-BFG a Hb O 2 iránti affinitását? A probléma megoldásához válaszoljon a következő kérdésekre:
1.Hol és miből szintetizálják a 2,3-biszfoszfoglicerátot (2,3-BFG)? Írja fel a képletét, jelölje meg egy adott molekula töltését!
2. Milyen formájú hemoglobinnal (oxi vagy dezoxi) lép kölcsönhatásba a BFH és miért? A HB molekula melyik részében megy végbe a kölcsönhatás?
3. melyik irányba mutat a folyamat az ábrán
a) szöveti kapillárisokban;
b) a tüdő kapillárisaiban?
4.ahol nagyobbnak kell lennie a komplex koncentrációjának
NV-2,3-BFG:
a) nyugalmi izmok kapillárisaiban,
b) a dolgozó izmok kapillárisaiban (a vörösvértestekben azonos BFG-koncentrációt feltételezve)?
5. Hogyan változik a Hb oxigén iránti affinitása, amikor az ember alkalmazkodik a magas tengerszint feletti körülményekhez, ha megnő a BFG koncentrációja a vörösvértestekben? Mi ennek a jelenségnek a fiziológiai jelentősége?
4. A 2,3-BFG megsemmisülése a konzervvér tárolása során megzavarja a HB működését. Hogyan fog megváltozni a Hb affinitása az O 2 -hoz a tartósított vérben, ha a 2,3-BFG koncentrációja a vörösvértestekben 8-ról 0,5 mmol / l-re csökkenhet. Lehetséges-e ilyen vér transzfúziója kritikus állapotú betegeknek, ha a 2,3-BFG koncentrációja legkorábban három nappal később helyreáll? Lehetséges-e helyreállítani a vörösvértestek működését 2,3-BFG vérbe adásával?
5. Emlékezzen az immunglobulinok legegyszerűbb molekuláinak szerkezetére. Milyen szerepet játszanak az immunglobulinok az immunrendszerben? Miért nevezik az Ig-t gyakran bivalenseknek? Hogyan kapcsolódik az Ig szerkezete működésükhöz? (Írjon le egy példát az immunglobulinok egy osztályára.)
A fehérjék fizikai-kémiai tulajdonságai és elválasztásuk módszerei.
6. Hogyan befolyásolja a fehérje nettó töltése az oldhatóságát?
a) határozzuk meg a peptid teljes töltését pH 7-nél
Ala-Glu-Tre-Pro-Asp-Liz-Cis
b) hogyan változik ennek a peptidnek a töltése pH> 7, pH értéknél<7, рН <<7?
c) mi a fehérje izoelektromos pontja (IEP), és milyen környezetben található
Ennek a peptidnek az IEP-je?
d) milyen pH-értéken figyelhető meg ennek a peptidnek a legkisebb oldhatósága.
7. A savanyú tej a friss tejjel ellentétben miért „alvadékosodik meg” forrás közben (azaz a kazein tejfehérje kicsapódik)? A friss tejben a kazein molekulák negatív töltéssel rendelkeznek.
8. A gélszűrési módszert az egyes fehérjék elkülönítésére használják. A 160 000, 80 000 és 60 000 molekulatömegű A, B, C fehérjéket tartalmazó keveréket gélszűréssel elemeztük (1.35. ábra). A megduzzadt gélszemcsék átjárhatóak a 70 000-nél kisebb molekulatömegű fehérjék számára. Mi az elv az elválasztási módszer mögött? Melyik grafikon ábrázolja helyesen a frakcionálási eredményeket? Adja meg, hogy az A, B és C fehérjék milyen sorrendben jönnek ki az oszlopból.
 Rizs. 1.35. Gélszűrési módszer alkalmazása a fehérjék elválasztására
Rizs. 1.35. Gélszűrési módszer alkalmazása a fehérjék elválasztására
9. ábrán. 1.36, A egy diagramot mutat az elektroforézisről papíron egy egészséges ember vérszérumfehérjéiről. Az ezzel a módszerrel kapott fehérjefrakciók relatív mennyiségei: albuminok 54-58%, α1-globulinok 6-7%, α2-globulinok 8-9%, β-globulinok 13%, γ-globulinok 11-12%. ..
 Rizs. 1.36 Elektroforézis papíron egészséges ember (A) és beteg (B) vérplazmafehérjéiről
Rizs. 1.36 Elektroforézis papíron egészséges ember (A) és beteg (B) vérplazmafehérjéiről
I - y-globulinok; II - β-globulinok; III -α 2-globulin; IV -α 2-globulin; V - albumin
Sok betegséget kísérnek a szérumfehérjék összetételének mennyiségi változásai (dysproteinémia). E változások természetét a diagnózis felállításakor, valamint a betegség súlyosságának és stádiumának értékelése során figyelembe veszik.
táblázatban megadott adatok felhasználásával. ábrán látható elektroforetikus profillal jellemezhető betegségről tételezzen fel feltételezést. 1.36.
1.5. táblázat. A szérumfehérjék koncentrációjának változása patológiában
Ppt% 5C34928-slozhnye_belki_ch1_1.jpg "alt =" (! LANG:> A fehérje aktív centruma és kölcsönhatása a ligandummal. A harmadlagos szerkezet kialakulása során"> Активный центр белка и его взаимодействие с лигандом. В процессе формирования третичной структуры на поверхности функционально активного белка, обычно в углублении, образуется участок, сформированный радикалами аминокислот, далеко стоящими друг от друга в первичной структуре. Этот участок, имеющий уникальное строение для данного белка и способный специфично взаимодействовать с определенной молекулой или группой похожих молекул, называется центром связывания белка с лигандом или активным центром. Лигандами называются молекулы, взаимодействующие с белками.!}
Ppt% 5C34928-slozhnye_belki_ch1_2.jpg "alt =" (! LANG:> A ligandum lehet kis molekulatömegű vagy nagy molekulatömegű (makromolekula) anyag, beleértve"> Лигандом может быть как низкомолекулярное, так и высокомолекулярное (макромолекула) вещество, в том числе и другой белок. Лигандами являются субстраты ферментов, кофакторы, ингибиторы и активаторы ферментов, протомеры в олигомерном белке и т.д.!}
Ppt% 5C34928-slozhnye_belki_ch1_3.jpg "alt =" (! LANG:> A fehérje és a ligandum kölcsönhatásának nagy specificitását az aktív centrum szerkezetének a ligandum szerkezetével való komplementaritása biztosítja.">!}
Ppt% 5C34928-slozhnye_belki_ch1_4.jpg "alt =" (! LANG:> A komplementaritás a kölcsönhatásban lévő felületek térbeli és kémiai megfeleltetése. Egy aktív hely nem csak"> Комплементарность - это пространственное и химическое соответствие взаимодействующих поверхностей. Активный центр должен не только пространственно соответствовать входящему в него лиганду, но и между функциональными группами радикалов, входящих в активный центр, и лигандом должны образоваться связи чаще всего нековалентные (ионные, водородные, а также гидрофобные взаимодействия), которые удерживают лиганд в активном центре.!}
Ppt% 5C34928-slozhnye_belki_ch1_5.jpg "alt =" (! LANG:> Komplementer fehérje-ligandum kölcsönhatás">!}
Ppt% 5C34928-slozhnye_belki_ch1_6.jpg "alt ="> ">
Ppt% 5C34928-slozhnye_belki_ch1_7.jpg "alt ="> ">
Ppt% 5C34928-slozhnye_belki_ch1_8.jpg "alt =" (! LANG:> FEHÉRJÉNEK OSZTÁLYOZÁSA 1. Az egyszerű fehérjék csak aminosavakból állnak. 2. Komplex fehérjék (holoproteinek)"> КЛАССИФИКАЦИЯ БЕЛКОВ 1. Простые белки состоят только из аминокислот. 2. Сложные белки (холопротеины) содержат белковую часть (апопротеин) и небелковую (простетическую) группу.!}
Ppt% 5C34928-slozhnye_belki_ch1_9.jpg "alt =" (! LANG:> Protetikai csoportként különféle szerves (lipidek, szénhidrátok) és szervetlen (fémek) anyagok működhetnek."> В качестве простетической группы могут выступать различные органические (липиды, углеводы) и неорганические (металлы) вещества. Связь между простетической группой и апопротеином может быть как ковалентная, так и нековалентная. Простетическую группу порой можно рассматривать в качестве лиганда. Наличие небелковой части обеспечивает выполнение белком его функции. При утрате простетической группы холопротеин теряет свою активность.!}
Ppt% 5C34928-slozhnye_belki_ch1_10.jpg "alt =" (! LANG:> Komplex fehérjék - kromoproteinek - nukleoproteinek - lipoproteinek - foszfoproteinek - glikoproteinek - metalloproteinek">!}
Ppt% 5C34928-slozhnye_belki_ch1_11.jpg "alt =" (! LANG:> A metalloproteinek közé tartoznak a nem hem koordinált fémionokat tartalmazó holoenzimek."> Металлопротеинам можно отнести холоферменты, содержащие негемовые координационно связанные ионы металлов. Среди металлопротеинов есть белки, выполняющие депонирующие и транспортные функции (например, железосодержащие ферритин и трансферрин) и ферменты (например, цинксодержащая карбоангидраза и различные супероксиддисмутазы, содержащие в качестве активных центров ионы меди, марганца, железа и других металлов). Но и хромопротеины, содержащие ионы металлов, также можно отнести к металлопротеинам.!}
Ppt% 5C34928-slozhnye_belki_ch1_12.jpg "alt =" (! LANG:> A metalloproteinek gyakran enzimek. A fémionok ebben az esetben: - részt vesznek a szubsztrát orientációjában"> Металлопротеины часто являются ферментами. Ионы металлов в этом случае: - участвуют в ориентации субстрата в активном центре фермента, входят в состав активного центра фермента и участвуют в катализе, являясь, например, акцепторами электронов на определенной стадии ферментативной реакции. Часто ион металла в составе фермента называют кофактором.!}
Ppt% 5C34928-slozhnye_belki_ch1_13.jpg "alt =" (! LANG:> Az enzimatikus metalloproteinek olyan fehérjéket tartalmaznak, amelyek például: - réz - citokróm-oxidázt tartalmaznak komplexben"> К ферментативным металлопротеинам относятся белки, содержащие например: - медь – цитохромоксидаза, в комплексе с другими ферментами дыхательной цепи митохондрий участвует в синтезе АТФ, - железо – ферритин, депонирующий железо в клетке, трансферрин, переносящий железо в крови, каталаза, обезвреживающая перекись водорода, - цинк – алкогольдегидрогеназа, обеспечивающая метаболизм этанола и других спиртов, лактатдегидрогеназа, участвующая в метаболизме молочной кислоты, - карбоангидраза, образующая угольную кислоту из CO2 и H2O, - щелочная фосфатаза, гидролизующая фосфорные эфиры различных соединений, - α2-макроглобулин, антипротеазный белок крови. - селен – тиреопероксидаза, участвующая в синтезе гормонов щитовидной железы, антиоксидантный фермент глутатионпероксидаза, - кальций – α-амилаза слюны и панкреатического сока, гидролизующая крахмал.!}
Ppt% 5C34928-slozhnye_belki_ch1_14.jpg "alt =" (! LANG:> Ferritin">!}
Ppt% 5C34928-slozhnye_belki_ch1_15.jpg "alt =" (! LANG:> A foszfoproteinek olyan fehérjék, amelyekben foszfátcsoport van jelen. A peptidlánchoz kötődik"> Фосфопротеины – это белки, в которых присутствует фосфатная группа. Она связывается с пептидной цепью через остатки тирозина, серина и треонина, т.е. тех аминокислот, которые содержат ОН-группу. Способ присоединения фосфата к белку на примере серина и тирозина!}
Ppt% 5C34928-slozhnye_belki_ch1_16.jpg "alt =" (! LANG:> A foszforsav képes: - Szerkezeti szerepet, töltést, oldhatóságot és változó tulajdonságokat kölcsönöz"> Фосфорная кислота может выполнять: - Структурную роль, придавая заряд, растворимость и изменяя свойства белка, например, в казеине молока, яичном альбумине. Наличие остатков фосфорной кислоты способствует связыванию кальция, что необходимо для формирования, например, костной ткани. - Функциональную роль. В клетке присутствует много белков, которые связаны с фосфатом не постоянно, а в зависимости от активности метаболизма. Белок может многократно переходить в фосфорилированную или в дефосфорилированную форму, что играет регулирующую роль в его работе.!}
Ppt% 5C34928-slozhnye_belki_ch1_17.jpg "alt =" (! LANG:> A foszforiláció az a folyamat, amelynek során a foszforiláló donorszerből a foszforsav-maradék a szubsztrátumba kerül, általában"> Фосфорилирование - процесс переноса остатка фосфорной кислоты от фосфорилирующего агента-донора к субстрату, как правило, катализируемый ферментами (киназами) и ведущий к образованию эфиров фосфорной кислоты. Дефосфорилирование (утрату остатка фосфорной кислоты) катализируют фосфатазы. АТФ + R-OH → АДФ + R-OPO3H2 R-OPO3H2 + Н2О → R-OH + Н3РО4!}
Ppt% 5C34928-slozhnye_belki_ch1_18.jpg "alt =" (! LANG:> Példák: 1) glikogén-szintáz és glikogén-foszforiláz enzimek 2) foszforilált hisztonok kevésbé erősen kötődnek"> Примеры: 1) ферменты гликогенсинтаза и гликогенфосфорилаза 2) гистоны в фосфорилированном состоянии менее прочно связываются с ДНК и активность генома возрастает. Изменение конформации белка в фосфорилированном и дефосфорилированном состоянии!}
Ppt% 5C34928-slozhnye_belki_ch1_19.jpg "alt =" (! LANG:> A lipoproteinek protetikai részként nem kovalensen kötött lipideket tartalmaznak. A lipidek, különösen"> Липопротеины содержат в качестве простетической части нековалентно связанные липиды. Липиды, в частности жиры, холестерол и его эфиры не растворяются в водных фазах организма, поэтому транспорт их кровью и лимфой осуществляется в виде комплексов с белками и фосфолипидами, которые называются липопротеинами.!}
Ppt% 5C34928-slozhnye_belki_ch1_20.jpg "alt =" (! LANG:> Minden lipoprotein szerkezete hasonló: a mag hidrofób molekulákból áll: triacilglicerolok, koleszterin-észterek, ill."> Все липопротеины имеют сходное строение: ядро состоит из гидрофобных молекул: триацилглицеролов, эфиров холестерола, а на поверхности находится монослой фосфолипидов, полярные группы которых обращены к воде, а гидрофобные погружены в гидрофобное ядро липопротеина. Кроме фосфолипидов, на поверхности находятся белки – аполипопротеины (апобелками). Их выделяют несколько видов: А, В, С, D. В каждом типе липопротеинов преобладают соответствующие ему апобелки. Аполипопротеины выполняют различные функции. Интегральные аполипопротеины являются структурными компонентами. Периферические аполипопротеины в плазме крови могут передаваться от одного типа липопротеинов к другим, определяя их дальнейшие превращения.!}
Ppt% 5C34928-slozhnye_belki_ch1_21.jpg "alt =" (! LANG:> A lipoprotein szerkezetének diagramja A lipoprotein szerkezete">!}
Ppt% 5C34928-slozhnye_belki_ch1_22.jpg "alt =" (! LANG:> A vérplazma lipoproteinek szerkezete">!}
Ppt% 5C34928-slozhnye_belki_ch1_23.jpg "alt =" (! LANG:> A lipoproteineknek négy fő osztálya van: - nagy sűrűségű lipoproteinek (HDL), - alacsony sűrűségű lipoproteinek (LDL),"> Выделяют четыре основных класса липопротеинов: -липопротеины высокой плотности (ЛПВП), -липопротеины низкой плотности (ЛПНП), -липопротеины очень низкой плотности (ЛПОНП), -хиломикроны (ХМ). Каждый из типов ЛП образуется в разных тканях и транспортирует определённые липиды. Концентрация и соотношение в крови тех или иных липопротеинов играют ведущую роль в возникновении такой распространенной сосудистой патологии как атеросклероз. ЛПВП являются антиатерогенными, ЛПНП и ЛПОНП – атерогенными.!}
Ppt% 5C34928-slozhnye_belki_ch1_24.jpg "alt ="> ">
Ppt% 5C34928-slozhnye_belki_ch1_25.jpg "alt =" (! LANG:> A glikoproteinek vagy glikokonjugátumok olyan fehérjék, amelyek szénhidrát komponenst tartalmaznak kovalensen kapcsolva egy polipeptid bázishoz."> Гликопротеины или, гликоконъюгаты – это белки, содержащие углеводный компонент, ковалентно присоединенный к полипептидной основе. Содержание углеводов в них варьирует от 1% до 98% по массе. Два подкласса белков, содержащих углеводы: ■ протеогликаны ■ гликопротеины!}
Leírás = "">
Ppt% 5C34928-slozhnye_belki_ch1_27.jpg "alt =" (! LANG:> A glikoproteineket alacsony szénhidráttartalom jellemzi, amelyek: - N-glikozidos kötéssel kötődnek néhány NH2-csoporthoz"> Для гликопротеинов характерно невысокое содержание углеводов, которые присоединены: - N-гликозидной связью к NН2-группе какого-нибудь аминокислотного остатка, например, аспарагина; - О-гликозидной связью к гидроксильной группе остатка серина, треонина,тирозина, гидроксилизина.!}
Ppt% 5C34928-slozhnye_belki_ch1_28.jpg "alt =" (! LANG:> O- és N-glikozidos kötések kialakulása glikoproteinekben. 1 - N-glikozidos kötés az amidcsoport között"> Образование О- и N-гликозидных связей в гликопротеинах. 1 - N-гликозидная связь между амидной группой аспарагина и ОН-группой моносахарида; 2 - О-гликозидная связь между ОН-группой серина и ОН-группой моносахарида.!}
Ppt% 5C34928-slozhnye_belki_ch1_29.jpg "alt =" (! LANG:> A szénhidrát fehérjéhez kapcsolásának módja">!}
Ppt% 5C34928-slozhnye_belki_ch1_30.jpg "alt =" (! LANG:> A glikoproteinek funkciói: 1. Szerkezeti - bakteriális sejtfal, csontmátrix, pl. kollagén, elasztin."> Функцией гликопротеинов являются: 1. Структурная – клеточная стенка бактерий, костный матрикс, например, коллаген, эластин. 2. Защитная – например, антитела, интерферон, факторы свертывания крови (протромбин, фибриноген). 3. Рецепторная – присоединение эффектора приводит к изменению конформации белка-рецептора, что вызывает внутриклеточный ответ. 4. Гормональная – гонадотропный, адренокортикотропный и тиреотропный гормоны. 5. Ферментативная – холинэстераза, нуклеаза. 6. Транспортная – перенос веществ в крови и через мембраны, например, трансферрин, транскортин, альбумин, Na+,К+-АТФаза.!}
Ppt% 5C34928-slozhnye_belki_ch1_31.jpg "alt =" (! LANG:> A fehérjereceptor szerkezetének diagramja">!}
Ppt% 5C34928-slozhnye_belki_ch1_32.jpg "alt =" (! LANG:> A kromoproteinek a különböző kémiai természetű színes protetikus csoportokkal rendelkező összetett fehérjék gyűjtőneve."> Хромопротеины - собирательное название сложных белков с окрашенными простетическими группами различной химической природы. гемопротеины (содержат гем), ретинальпротеины (содержат витамин А), флавопротеины (содержат витамин В2), кобамидпротеины (содержат витамин В12).!}
Ppt% 5C34928-slozhnye_belki_ch1_33.jpg "alt =" (! LANG:> A flavoproteinek a redox reakciók enzimei. A B2-vitamin flavin-mononukleotid (FMN) és a flavin-adenin-dinukleotid származékait tartalmazzák."> Флавопротеины - это ферменты окислительно-восстановительных реакций. Содержат производные витамина В2 флавинмононуклеотид (ФМН) и флавинадениндинуклеотид (ФАД). Связываются данные простетические группы ковалентно и придают желтое окрашивание. Эти простетические группы являются производными изоаллоксазина.!}
Ppt% 5C34928-slozhnye_belki_ch1_34.jpg "alt =" (! LANG:> Az izoalloxazin egy pteridinből származó heterociklusos vegyület. Az izoalloxazin molekula három aromás gyűrűből áll -"> Изоаллоксазин - гетероциклическое соединения, производное птеридина. Молекула изоаллоксазина состоит из трех ароматических колец - бензольного, пиримидинового, пиразинового.!}
Ppt% 5C34928-slozhnye_belki_ch1_35.jpg "alt =" (! LANG:> Hemet tartalmazó kromoproteinek. Szerkezetileg hasonló vas- vagy magnézium-porfirinek szerepelnek nem fehérjekomponensként."> Гемопротеины - гем-содержащие хромопротеины. В качестве небелкового компонента включают структурно сходные железо- или магнийпорфирины. Белковый компонент может быть разнообразным как по составу, так и по структуре. Основу структуры простетической группы большинства гемосодержащих белков составляет порфириновое кольцо, являющееся в свою очередь производным тетрапиррольного соединения – порфирина. Порфирин!}
Ppt% 5C34928-slozhnye_belki_ch1_36.jpg "alt =" (! LANG:> A porfiringyűrű különböző fémionokkal képes koordinációs vegyületeket képezni."> Порфириновое кольцо способно образовывать координационные соединения с различными ионами металлов. В результате комплексообразования формируются металлопорфирины: содержащие ионы железа – гемоглобины, миоглобин, цитохромы, пероксидаза, каталаза и др. (красное окрашивание), содержщие ионы магния – хлорофилл (зеленое окрашивание). Витамин В12 (кобалимин) содержит координированный ион кобальта Со2+ в порфириноподобном макроцикле – коррине, состоящем из четырех частично гидрированных пиррольных колец (розовое окрашивание).!}
Ppt% 5C34928-slozhnye_belki_ch1_37.jpg "alt =" (! LANG:> Klorofil b. A klorofillok részt vesznek a fotoszintézisben.">!}
Ppt% 5C34928-slozhnye_belki_ch1_38.jpg "alt =" (! LANG:> A citokrómok a peptidláncok aminosav-összetételében, a láncok számában különböznek egymástól, és a, b,"> Цитохромы различаются аминокислотным составом пептидных цепей, числом цепей и разделяются на типы а, b, с, d. Цитохромы находятся в составе дыхательной цепи и цепи микросомального окисления. Степень окисления железа в составе цитохромов меняется в отличие от гемоглобина и миоглобина Fe2+ ↔ Fe3+!}
Ppt% 5C34928-slozhnye_belki_ch1_39.jpg "alt =" (! LANG:> A mioglobin (MB) a vörös izmokban található fehérje, amelynek fő funkciója a raktározás"> Миоглобин (Мв) - белок, находящийся в красных мышцах, основная функция которого - создание запасов О2, необходимых при интенсивной мышечной работе. Мв - сложный белок, содержащий белковую часть - апоМв и небелковую часть - гем. Первичная структура апоМв определяет его компактную глобулярную конформацию и структуру активного центра, к которому присоединяется небелковая часть миоглобина - гем. Кислород, поступающий из крови в мышцы, связывается с Fe2+ гема в составе миоглобина. Мв - мономерный белок, имеющий очень высокое сродство к О2, поэтому отдача кислорода миоглобином происходит только при интенсивной мышечной работе, когда парциальное давление O2 резко снижается. Формирование пространственных структур и функционирование миоглобина.!}
Ppt% 5C34928-slozhnye_belki_ch1_40.jpg "alt =" (! LANG:> Az MB konformáció kialakulása."> Формирование конформации Мв. В красных мышцах на рибосомах в ходе трансляции идет синтез первичной структуры Мв, представленной специфической последовательностью 153 аминокислотных остатков. Вторичная структура Мв содержит восемь α-спиралей, называемых латинскими буквами от А до Н, между которыми имеются неспирализованные участки. Третичная структура Мв имеет вид компактной глобулы, в углублении которой между F и Е α-спиралями расположен активный центр.!}
Ppt% 5C34928-slozhnye_belki_ch1_41.jpg "alt =" (! LANG:> Mioglobin szerkezete">!}
Ppt% 5C34928-slozhnye_belki_ch1_42.jpg "alt =" (! LANG:> Az MB aktív centrum felépítésének és működésének jellemzői. Az MB aktív centrumot főleg hidrofób gyökök alkotják"> Особенности строения и функционирования активного центра Мв. Активный центр Мв сформирован преимущественно гидрофобными радикалами аминокислот, далеко отстоящими друг от друга в первичной структуре (например, Три39 и Фен138). К активному центру присоединяется плохо растворимые в воде лиганды - гем и О2. Гем - специфический лиганд апоМв.!}
Ppt% 5C34928-slozhnye_belki_ch1_43.jpg "alt =" (! LANG:> A hem négy pirrolgyűrűn alapul, amelyeket methenil hidak kötnek össze; a Fe2 + atom a központban található,"> Основу гема составляют четыре пиррольных кольца, соединенных метенильными мостиками; в центре расположен атом Fe2+, соединенный с атомами азота пиррольных колец четырьмя координационными связями. В активном центре Мв кроме гидрофобных радикалов аминокислот имеются также остатки двух аминокислот с гидрофильными радикалами - Гис Е7 (Гис64) и Гис F8 (Гис93).!}
Ppt% 5C34928-slozhnye_belki_ch1_44.jpg "alt =" (! LANG:> F8-ja koordinációs kötést képez Fe2+-szal, és szilárdan rögzíti a hemet az aktív központban."> Гис F8 образует координационную связь с Fe2+ и прочно фиксирует гем в активном центре. Гис Е7 необходим для правильной ориентации в активном центре другого лиганда - O2 при его взаимодействии с Fe+2 гема. Микроокружение гема создает условия для прочного, но обратимого связывания O2 с Fe+2 и препятствует попаданию в гидрофобный активный центр воды, что может привести к его окислению в Fе3+.!}
Ppt% 5C34928-slozhnye_belki_ch1_45.jpg "alt =" (! LANG:> A HB oligomer szerkezete és a HB O2 ligandumokhoz való affinitásának szabályozása. Humán hemoglobinok -"> Олигомерное строение Нв и регуляция сродства Нв к О2 лигандами. Гемоглобины человека - семейство белков, так же как и миоглобин относящиеся к сложным белкам (гемопротеинам). Они имеют тетрамерное строение и содержат две α-цепи, но различаются по строению двух других полипептидных цепей (2α-, 2х-цепи). Строение второй полипептидной цепи определяет особенности функционирования этих форм Нв. Около 98% гемоглобина эритроцитов взрослого человека составляет гемоглобин А (2α-, 2β-цепи). В период внутриутробного развития функционируют два основных типа гемоглобинов: эмбриональный Нв (2α, 2ε), который обнаруживается на ранних этапах развития плода, и гемоглобин F (фетальный) - (2α, 2γ), который приходит на смену раннему гемоглобину плода на шестом месяце внутриутробного развития и только после рождения замещается на Нв А.!}
Ppt% 5C34928-slozhnye_belki_ch1_46.jpg "alt =" (! LANG:> A HB A a mioglobinnal (MB) rokon fehérje, amely felnőttek eritrocitáiban található."> Нв А - белок, родственный миоглобину (Мв), содержится в эритроцитах взрослого человека. Строение его отдельных протомеров аналогично таковому у миоглобина. Вторичная и третичная структуры миоглобина и протомеров гемоглобина очень сходны, несмотря на то что в первичной структуре их полипептидных цепей идентичны только 24 аминокислотных остатка (вторичная структура протомеров гемоглобина, так же как миоглобин, содержит восемь α-спиралей, обозначаемых латинскими буквами от А до Н, а третичная структура имеет вид компактной глобулы). Но в отличие от миоглобина гемоглобин имеет олигомерное строение, состоит из четырех полипептидных цепей, соединенных нековалентными связями.!}
Ppt% 5C34928-slozhnye_belki_ch1_47.jpg "alt =" (! LANG:> Hemoglobin oligomer szerkezete">!}
Ppt% 5C34928-slozhnye_belki_ch1_48.jpg "alt =" (! LANG:> Minden HB protomer egy nem fehérje résszel van társítva - hem és szomszédos protomerek."> Каждый протомер Нв связан с небелковой частью - гемом и соседними протомерами. Соединение белковой части Нв с гемом аналогично таковому у миоглобина: в активном центре белка гидрофобные части гема окружены гидрофобными радикалами аминокислот за исключением Гис F8 и Гис Е7, которые расположены по обе стороны от плоскости гема и играют аналогичную роль в функционировании белка и связывании его с кислородом. Кроме того, Гис Е7 выполняет важную дополнительную роль в функционировании Нв. Свободный гем имеет в 25 000 раз более высокое сродство к СО, чем к О2. СО в небольших количествах образуется в организме и, учитывая его высокое сродство к гему, он мог бы нарушать транспорт необходимого для жизни клеток О2. Однако в составе гемоглобина сродство гема к оксиду углерода превышает сродство к О2 всего в 200 раз благодаря наличию в активном центре Гис Е7. Остаток этой аминокислоты создает оптимальные условия для связывания гема с O2 и ослабляет взаимодействие гема с СО.!}
Ppt% 5C34928-slozhnye_belki_ch1_49.jpg "alt ="> ">
Ppt% 5C34928-slozhnye_belki_ch1_50.jpg "alt =" (! LANG:> A hem pirrol gyűrűi ugyanabban a síkban helyezkednek el, a Fe2 + ion pedig oxigénmentes állapotban van Hb"> Пиррольные кольца гема расположены в одной плоскости, а ион Fe2+ в неоксигенированом состоянии Hb выступает над плоскостью на 0,6 А. При присоединении кислорода ион железа погружается в плоскость колец гема. В результате сдвигается и участок полипептидной цепи, нарушаются слабые связи в молекуле Hb и изменяется конформация всей глобулы. Таким образом, присоединение кислорода вызывает изменение пространственной структуры молекулы миоглобина или протомеров гемоглобина.!}
Ppt% 5C34928-slozhnye_belki_ch1_51.jpg "alt =" (! LANG:> A hemoglobin szabad (dezoxihemoglobin) és oxigéndús formában is létezhet, a"> Гемоглобин может существовать как в свободной (дезоксигемоглобин), так и в оксигенированной форме, присоединяя до 4 молекул кислорода. Взаимодействие с кислородом 1-го протомера вызывает изменение его конформации, а также кооперативные конформационные изменения остальных протомеров. Сродство к кислороду возрастает, и присоединение О2 к активному центру 2-го протомера происходит легче, вызывая дальнейшую конформационную перестройку всей молекулы. В результате еще сильнее изменяется структура оставшихся протомеров и их активных центров, взаимодействие с О2 еще больше облегчается. В итоге 4-я молекула кислорода присоединяется к Hb примерно в 300 раз легче, чем 1-я. Так происходит в легких при высоком парциальном давлении кислорода.!}
Ppt% 5C34928-slozhnye_belki_ch1_52.jpg "alt =" (! LANG:> Kooperatív változások a hemoglobin molekula konformációjában oxigénnel való kölcsönhatás hatására">!}
Ppt% 5C34928-slozhnye_belki_ch1_53.jpg "alt =" (! LANG:> Azokban a szövetekben, ahol az oxigéntartalom alacsonyabb, éppen ellenkezőleg, az egyes O2 molekulák hasadása elősegíti a következő molekulák felszabadulását."> В тканях, где содержание кислорода ниже, наоборот, отщепление каждой молекулы О2 облегчает освобождение последующих. Таким образом, взаимодействие олигомерного белка гемоглобина с лигандом (О2) в одном центре связывания приводит к изменению конформации всей молекулы и других, пространственно удаленных центров, расположенных на других субъединицах (принцип «домино»). Подобные взаимосвязанные изменения структуры белка называют кооперативными конформационными изменениями. Они характерны для всех олигомерных белков и используются для регуляции их активности.!}
Ppt% 5C34928-slozhnye_belki_ch1_54.jpg "alt =" (! LANG:> Mindkét fehérje (Mb és Hb) kölcsönhatása oxigénnel a parciális nyomásától függ"> Взаимодействие обоих белков (Mb и Hb) с кислородом зависит от его парциального давления в тканях. Эта зависимость имеет разный характер, что связано с их особенностями структуры и функционирования. Гемоглобин имеет S-образную кривую насыщения, которая показывает, что субъединицы белка работают кооперативно, и чем больше кислорода они отдают, тем легче идет освобождение остальных молекул О2. Этот процесс зависит от изменения парциального давления кислорода в тканях. График насыщения миоглобина кислородом имеет характер простой гиперболы, т.е. насыщение Mb кислородом происходит быстро и отражает его функцию - обратимое связывание с кислородом, высвобождаемым гемоглобином, и освобождение в случае интенсивной физической нагрузки.!}
Ppt% 5C34928-slozhnye_belki_ch1_55.jpg "alt =" (! LANG:> Mioglobin és hemoglobin oxigéntelítettségi görbéi">!}
Ppt% 5C34928-slozhnye_belki_ch1_56.jpg "alt =" (! LANG:> A szerves anyagok lebontása során keletkező CO2 és H + arányosan csökkenti a hemoglobin affinitását az O2-hoz"> CO2 и Н+, образующиеся при катаболизме органических веществ, уменьшают сродство гемоглобина к О2 пропорционально их концентрации. Энергия, необходимая для работы клеток, вырабатывается преимущественно в митохондриях при окислении органических веществ с использованием O2, доставляемого из легких гемоглобином. В результате окисления органических веществ образуются конечные продукты их распада: СО2 и Н2O, количество которых пропорционально интенсивности протекающих процессов окисления. СO2 диффузией попадает из клеток в кровь и проникает в эритроциты, где под действием фермента карбоангидразы превращается в угольную кислоту. Эта слабая кислота диссоциирует на протон и бикарбонат ион. СО2 + Н2О → Н2СО3 → Н+ + НСО3-!}
Ppt% 5C34928-slozhnye_belki_ch1_57.jpg "alt =" (! LANG:> A H + ionok képesek kapcsolódni a hemoglobin β-láncaiban lévő His146 gyökökhöz, vagyis a távoli területeken"> Ионы Н+ способны присоединятся к радикалам Гис146 в β-цепях гемоглобина, т.е. в участках, удаленных от гема. Протонирование гемоглобина снижает его сродство к О2, способствует отщеплению О2 от оксиНв, образованию дезоксиНв и увеличивает поступление кислорода в ткани пропорционально количеству образовавшихся протонов. Увеличение количества освобожденного кислорода в зависимости от увеличения концентрации Н+ в эритроцитах называется эффектом Бора (по имени датского физиолога Христиана Бора, впервые открывшего этот эффект). В легких высокое парциальное давление кислорода способствует его связыванию с дезоксиНв, что уменьшает сродство белка к Н+. Освободившиеся протоны под действием карбоангидразы взаимодействуют с бикарбонатами с образованием СО2 и Н2О!}
Ppt% 5C34928-slozhnye_belki_ch1_58.jpg "alt =" (! LANG:> A Hb O2-affinitásának függősége a CO2 és a protonok koncentrációjától (Bohr-effektus): A -"> Зависимость сродства Нв к О2 от концентрации СО2 и протонов (эффект Бора): А - влияние концентрации СО2 и Н+ на высвобождение О2 из комплекса с Нв (эффект Бора); Б - оксигенирование дезоксигемоглобина в легких, образование и выделение СО2.!}
Ppt% 5C34928-slozhnye_belki_ch1_59.jpg "alt =" (! LANG:> A keletkező CO2 bejut az alveoláris térbe, és a kilélegzett levegővel távozik."> Образовавшийся СО2 поступает в альвеолярное пространство и удаляется с выдыхаемым воздухом. Таким образом, количество высвобождаемого гемоглобином кислорода в тканях регулируется продуктами катаболизма органических веществ: чем интенсивнее распад веществ, например при физических нагрузках, тем выше концентрация СО2 и Н+ и тем больше кислорода получают ткани в результате уменьшения сродства Нв к О2.!}
Ppt% 5C34928-slozhnye_belki_ch1_60.jpg "alt =" (! LANG:> A fehérje funkcionális aktivitásában bekövetkező változást más ligandumokkal való kölcsönhatás során a konformációs változások miatt allosztérikusnak nevezzük"> Изменение функциональной активности белка при взаимодействии с другими лигандами вследствие конформационных изменений называется аллостерической регуляцией, а соединения-регуляторы - аллостерическими лигандами или эффекторами. Способность к аллостерической регуляции характерна, как правило, для олигомерных белков, т.е. для проявления аллостерического эффекта необходимо взаимодействие протомеров. При воздействии аллостерических лигандов белки меняют свою конформацию (в том числе и активного центра) и функцию.!}
Ppt% 5C34928-slozhnye_belki_ch1_61.jpg "alt =" (! LANG:> A HB O2-affinitásának alloszterikus szabályozása a 2,3-bisz-foszfoglicerát ligandum által. A termékből származó eritrocitákban"> Аллостерическая регуляция сродства Нв к О2 лигандом - 2,3-бис-фосфоглицератом. В эритроцитах из продукта окисления глюкозы - 1,3-бисфосфоглицерата синтезируется аллостерический лиганд гемоглобина - 2,3-бисфосфоглицерат (2,3-БФГ). В нормальных условиях концентрация 2,3-БФГ высокая и сравнима с концентрацией Нв. 2,3-БФГ имеет сильный отрицательный заряд (-5).!}
Ppt% 5C34928-slozhnye_belki_ch1_62.jpg "alt =" (! LANG:> A tetramer hemoglobin molekula közepén egy üreg található, amelyet mind a négy protomer aminosav-maradékai alkotnak."> В центре тетрамерной молекулы гемоглобина находится полость. Ее образуют аминокислотные остатки всех четырех протомеров. В капиллярах тканей протонирование Нв (эффект Бора) приводит к разрыву связи между железом гема и О2. В молекуле дезоксигемоглобина по сравнению с оксигемоглобином возникают дополнительные ионные связи, соединяющие протомеры, вследствие чего размеры центральной полости по сравнению с оксигемоглобином увеличиваются. Центральная полость является местом присоединения 2,3-БФГ к гемоглобину. БФГ поступает в полость дезоксигемоглобина. 2,3-БФГ взаимодействует с гемоглобином в участке, удаленном от активных центров белка и относится к аллостерическим (регуляторным) лигандам, а центральная полость Нв является аллостерическим центром. 2,3-БФГ имеет сильный отрицательный заряд и взаимодействует с положительно заряженными группами двух β-цепей Нв. При этом его сродство к О2 снижается в 26 раз. В результате происходит высвобождение кислорода в капиллярах ткани при низком парциальном давлении О2. В легких высокое парциальное давление О2, наоборот, приводит к оксигенированию Нв и освобождению БФГ.!}
Ppt% 5C34928-slozhnye_belki_ch1_63.jpg "alt =" (! LANG:> A BFG kötőközpont a 4 hemoglobin protomer közötti pozitív töltésű üregben található."> Центр связывания БФГ находится в положительно заряженной полости между 4 протомерами гемоглобина. Взаимодействие БФГ с центром связывания изменяет конформацию α- и β-протомеров НЬ и их активных центров. Сродство НЬ к молекулам О2 снижается и кислород высвобождается в ткани. В легких при высоком парциальном давлении О2 активные центры гемоглобина насыщаются за счет изменения конформации и БФГ вытесняется из аллостерического центра!}
Ppt% 5C34928-slozhnye_belki_ch1_64.jpg "alt ="> ">
Ppt% 5C34928-slozhnye_belki_ch1_65.jpg "alt =" (! LANG:> Így az oligomer fehérjék új tulajdonságokkal rendelkeznek a monomer fehérjékhez képest."> Таким образом, олигомерные белки обладают новыми по сравнению с мономерными белками свойствами. Присоединение лигандов на участках, пространственно удаленных друг от друга (аллостерических), способно вызывать конформационные изменения во всей белковой молекуле. Благодаря взаимодействию с регуляторными лигандами происходит изменение конформации и адаптация функции белковой молекулы к изменениям окружающей среды.!}
Ppt% 5C34928-slozhnye_belki_ch1_66.jpg "alt =" (! LANG:> A vérben lévő szén-dioxid körülbelül 15%-át hemoglobin molekulák hordozzák."> Около 15% углекислого газа, присутствующего в крови, переносится молекулами гемоглобина. В тканях часть молекул углекислого газа может присоединится к каждому протомеру молекулы гемоглобина, при этом снижается сродство Hb к кислороду. В легких, наоборот, из-за высокого парциального давления кислорода, О2 связывается с Hb, а СО2 высвобождается.!}
Ppt% 5C34928-slozhnye_belki_ch1_67.jpg "alt ="> ">
Ppt% 5C34928-slozhnye_belki_ch1_68.jpg "alt =" (! LANG:> A hemoglobin S molekulában (az ún. abnormális hemoglobinban) 2 β-lánc mutálódott, amelyben"> В молекуле гемоглобина S (так назван аномальный гемоглобин) мутантными оказались 2 β-цепи, в которых глутамат, высокополярная отрицательно заряженная аминокислота в положении 6 была заменена валином, содержащим гидрофобный радикал.!}