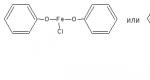
Fenolio hidroksilo grupės ir antioksidacinis aktyvumas. Alkoholių oksidacijos reakcija į aldehidus Reakcijos prie hidroksilo grupės
Fenolio hidroksilas yra hidroksilas, prijungtas prie aromatinio radikalo. Jame yra vaistų iš fenolių grupės (fenolio, rezorcinolio); fenolio rūgštys ir jų dariniai (salicilo rūgštis, fenilsalicilatas, salicilamidas, oksafenamidas); fenantreno izochinolino dariniai (morfino hidrochloridas, apomorfinas); sinestrolis, adrenalinas ir kt.
Fenolinio hidroksilo turinčių junginių chemines savybes lemia elektronų poros sąveika su aromatinio žiedo π-elektronais. Dėl šios sąveikos elektronų tankis pasislenka iš OH grupės į žiedą, sutrinka tolygus elektronų pasiskirstymas jame ir susidaro perteklinis neigiamas krūvis orto ( O)- ir pora ( P)-padėtys. Hidroksi grupės vandenilio atomas jonizuojasi ir suteikia fenoliams silpnų rūgščių savybių (fenolio pKa = 10,0; rezorcinolio pKa = 9,44). Todėl, skirtingai nei alkoholiai, jie sudaro druskas su šarmais (esant pH 12-13), tirpius kompleksinius junginius su geležies (III) chloridu (neutraliuose, silpnai šarminiuose ir rūgštiniuose tirpaluose).
Fenoliai pasižymi stipriomis redukuojančiomis savybėmis ir yra labai lengvai oksiduojami net silpnų oksidatorių. Jie sudaro spalvotus junginius su chinoidine struktūra.
Elektrofilinio vandenilio pakeitimo reakcijos O- Ir P-aromatinio žiedo padėtys – halogeninimas (brominimas), kondensacija su aldehidais, nitrinimas, derinimas su diazonio druskomis.
Remiantis fenolio hidroksilo ir jo aktyvuoto aromatinio žiedo savybėmis, vaistų analizėje naudojamos šios reakcijos:
1 – komplekso formavimas;
2 – halogeninimas (brominimas);
3 – azo deriniai;
4 – oksidacija;
5 – indofenolinių dažų susidarymas;
6 – kondensacija su aldehidais.
Identifikavimas
2.1. Kompleksinė reakcija su geležies jonais (III)
Jis pagrįstas fenolio hidroksilo savybėmis sudaryti tirpius kompleksinius junginius, dažnai mėlyną (fenolis) arba violetinę (rezorcinolis, salicilo rūgštis), rečiau raudoną (PAS - natrio) ir žalią (chinozolis, adrenalinas).
Kompleksų sudėtį, taigi ir spalvą, lemia fenolio hidroksilų kiekis, kitų funkcinių grupių įtaka, aplinkos reakcija.
Jei yra fenolio perteklius:

Numanoma galutinio produkto sudėtis reaguojant su fenoliu:


2.2. Aromatinio žiedo brominimo reakcija
Remiantis elektrofiliniu vandenilio pakeitimu O- Ir P- padėties ant bromo, susidarant netirpiam bromo dariniui (baltos nuosėdos).

Pagrindinės bromavimo taisyklės:
Bromas pakeičia vandenilį O- Ir P- padėties fenolio hidroksilo atžvilgiu (labiausiai reaguoja P- pozicija):

Jei yra O- arba P- pakaitų aromatinio žiedo padėtys, reaguoja mažiau bromo atomų;
Jei į O- arba P- padėtyse yra karboksilo grupė, tada, esant bromo pertekliui, vyksta dekarboksilinimas ir susidaro tribromo darinys:

Jei pavaduotojas yra m- padėtis, tada tai netrukdo formuotis tribromo dariniui:

Jei junginyje yra du fenolio hidroksilai m- padėtį, tada dėl jų koordinuotos orientacijos susidaro tribromo darinys:

Jei yra dvi hidroksilo grupės O- arba P- pozicijos vienas kitam, jie veikia nenuosekliai: brominimas nevyksta kiekybiškai:

Jei junginyje, be fenolio hidroksilų, yra amido arba esterio grupė (salicilamidas, fenilsalicilatas), norint juos kiekybiškai įvertinti bromatometriniu metodu, būtina atlikti išankstinę hidrolizę.
2.3. Azo jungties reakcija
Derinys taip pat eina į O- Ir P- nuostatas, šiuo atveju, kaip ir su bromu, pageidautina P- padėtis. Diazo reagentas yra diazonio druska (diazotuota sulfanilo rūgštis). Aplinka šarminga. Reakcijos produktas yra azodažiklis.

2.4. Oksidacijos reakcija
Fenoliai gali būti oksiduojami iki įvairių junginių, bet dažniausiai iki O- arba P-chinonai (cikliniai diketonai), rožinės arba, rečiau, geltonos spalvos.


2.5. Indofenolio dažų susidarymo reakcija
Jis pagrįstas fenolių oksidavimu į chinonus, kurie kondensuojantis su amoniaku arba amino dariniu ir fenolio pertekliumi sudaro indofenolinį dažiklį, spalvotą violetinę.


Šios reakcijos variantas yra Liebermano nitro reakcija, kuri būdinga fenoliams, kuriuose nėra pakaitų O- Ir P- nuostatas.
Rūgščioje aplinkoje veikiamas natrio nitrito susidaro P-nitrozofenolis, izomerizuojantis į P- chinoidoksimas, kuris, reaguodamas su fenolio pertekliumi rūgštinėje aplinkoje, sudaro indofenolį:

2.6. Nitrozo junginių susidarymas
Reaguodami su praskiesta azoto rūgštimi, fenoliai gali būti nitrinti kambario temperatūroje, sudarydami O- Ir P- nitro dariniai. Gautame nitro darinyje yra P- hidroksilo grupės judriojo vandenilio atomo padėtyje susidaro chinoidinės struktūros tautomerinė aci forma, kuri dažniausiai būna geltona. Įdėjus šarmų, spalva pagerėja, nes susidaro gerai disocijuota druska:

2.7. Kondensacijos reakcija su aldehidais arba rūgšties anhidridais
Su formaldehidu, esant koncentruotai sieros rūgščiai, kad susidarytų raudonos spalvos aurinis (arilmetanas) dažiklis.
Reakcija atitinka salicilo rūgšties farmakopėją. Koncentruota sieros rūgštis atlieka vandens šalinimo agento vaidmenį pirmajame reakcijos etape, o veikia kaip oksidatorius antroje.
Su ftalio anhidridu (lydymosi lydalo suliejimas ir vėlesnis ištirpimas šarme) rekomenduojamas pagal farmakopėją fenolio ir rezorcino identifikavimui.

kiekybinis įvertinimas
2.8. Bromatometrija
Metodas pagrįstas aromatinio žiedo vandenilio atomų elektrofiliniu pakeitimu bromu, išskirtu kalio bromatui reaguojant su kalio bromidu rūgščioje aplinkoje.
K  BrO 3 + 5KBr + 6 HCl → 3Br 2 + 6KCl + 3H 2 O
BrO 3 + 5KBr + 6 HCl → 3Br 2 + 6KCl + 3H 2 O
Naudojami tiesioginio ir atvirkštinio titravimo metodai. Tiesiogiai – titruokite kalio bromatu, kai yra kalio bromidas su metiloranžiniu arba metilraudonu indikatoriumi nuo rožinės iki pakitusios spalvos. Ekvivalentiškumo taške perteklinis kalio bromato lašas išskiria bromą, kuris oksiduoja indikatorių ir tirpalas tampa bespalvis. Atgalinio titravimo metu įvedamas kalio bromato perteklius, įpilama kalio bromido, sukuriama rūgštinė aplinka, palaikomas bromavimui reikalingas laikas, o po to bromo perteklius nustatomas jodometriškai (krakmolas – indikatorius).
Br 2 + 2KI → I 2 + 2KBr
I 2 + 2Na 2 S 2 O 3 → Na 2 S 4 O 6 + 2 NaI
Tiesioginio titravimo būdu timolis nustatomas pagal GF, o fenolis, rezorcinolis, salicilo rūgštis, sinestrolis ir kiti vaistai – atvirkštiniu titravimu.
M.E. = ¼ M.m. (timolis)
M.E. = 1/6 M.m. (fenolis, rezorcinolis, salicilo rūgštis)
M.E. = 1/8 M.m. (sinestrolis)
2.9. Jodometrija
Remiantis aromatinio žiedo vandenilio atomų elektrofiliniu pakeitimu jodu.

Norint surišti jodo rūgštį, kuri pakeičia pusiausvyrą priešinga kryptimi, pridedama natrio acetato arba natrio bikarbonato.
HI + NaHCO 3 → NaI + H 2 O + CO 2
HI + CH 3 COONa → NaI + CH 3 COOH
Naudojami tiesioginio ir atvirkštinio titravimo metodai. Pastarajame jodo perteklius titruojamas natrio tiosulfatu.
I 2 + 2NaS 2 O 3 → 2NaI + Na 2 S 4 O 6
M.E. = 1/6 M.m. (fenolis)
2.10. Jodo chlorometrija
Metodas pagrįstas aromatinio žiedo vandenilio atomų elektrofiliniu pakeitimu jodu, kuris yra jodo monochlorido dalis.

Naudojamas atgalinio titravimo metodas – jodo monochlorido perteklius nustatomas jodometriškai.
ICl + KI → I 2 + KCl
I 2 + 2Na 2S 2 O 6 → 2NaI + Na 2 S 4 O 6
M.E. = 1/6 M.m. (fenolis)
2.11. Acetilinimo metodas
Naudojamas pagal GF X kiekybiniam sinestrolio įvertinimui.

M.E. = ½ M.m.
2.12. Šarminis neutralizavimo protofiliniame tirpiklyje dimetilformamidas (DMF) metodas.
Fenolių vaistų grupės pasižymi labai silpnomis rūgštinėmis savybėmis, jų nustatymas šarminiu neutralizavimo metodu vandeninėje ar mišrioje terpėje yra neįmanomas, todėl titruojama nevandeninių tirpiklių, ypač DMF, terpėje. Metodas pagrįstas nustatytos silpnos rūgšties (fenolio) druskos susidarymu su titrantu (natrio metilatu) protofiliniame tirpiklyje, kuris sustiprina rūgštines savybes.

Iš viso:

2.13. Fotokolorimetrija (FEC) ir spektrofotometrija (SPM)
Jis pagrįstas spalvotų tirpalų savybe sugerti ne monochromatinę (FEC) arba monochromatinę (SPM) šviesą matomoje spektro srityje.
Spalvotų tirpalų gavimas;
Optinio tankio (D), kuris apibūdina elektromagnetinės spinduliuotės sugertį tirpale, kuriame yra analitės, matavimas;
Skaičiavimų atlikimas remiantis pagrindiniu šviesos sugerties dėsniu, naudojant kalibravimo grafiką, savitąjį sugerties koeficientą ir standartinį mėginio tirpalą.
Šiais metodais nustatant vaistus, kurių sudėtyje yra fenolio hidroksilo, spalvoti junginiai gaunami remiantis kompleksavimo reakcijomis su geležies (III) jonais, azo jungtimi su diazonio druskomis ir indofenolio dažų susidarymu.
Paskaita Nr.14
Tema: „Kokybinės reakcijos į funkcines grupes“
1) Hidroksilas (alkoholis, fenolis)
2) Karbonilas (aldehidas, karboksilas, esteris)
3) Pirminė aromatinė amino grupė, tretinė amino grupė (tretinis azotas)
4) Imidas, sulfamidas.
Funkcinės grupės (FG) – tai su anglies radikalu susiję atskiri atomai arba atomų grupės, kurios dėl būdingų savybių gali būti naudojamos vaistinėms medžiagoms apibrėžti.
I. Alkoholio hidroksilas. Alr-OH yra hidroksilas, prijungtas prie alifatinio angliavandenilio radikalo.
Remiantis alkoholio hidroksilu, analizuojant vaistus, kurių sudėtyje yra jo, naudojamos šios reakcijos:
Esterifikavimas (esterių susidarymas su rūgštimis arba jų anhidridais);
Oksidacija į aldehidus, o kai kuriais atvejais į rūgštis;
Kompleksavimas su vario (II) jonais šarminėje terpėje.
1.Esterifikacijos reakcija esant vandenį šalinančioms medžiagoms su rūgštimis arba jų anhidridais. Remiantis alkoholių savybe sudaryti esterius. Mažos molekulinės masės junginių atveju esteriai aptinkami pagal kvapą, kai analizuojami didelės molekulinės masės vaistai, pagal lydymosi temperatūrą.
Esterifikavimo reakcija yra etilo alkoholio farmakopėja.
CH 3 CH 2 OH + CH 3 COOH H2SO4→ CH 3 CH 2 OCOCH 3
2. Oksidacijos reakcija, remiantis alkoholių savybe oksiduotis iki aldehidų, kurie aptinkami pagal kvapą. Kaip reagentai naudojami įvairūs oksidatoriai: kalio permanganatas, kalio bichromatas, kalio heksacianoferatas (III) ir kt.. Didžiausią analitinę vertę turi kalio permanganatas, kurį sumažinus oksidacijos būsena pakeičiama nuo +7 iki + 2 ir pasikeičia spalva, t.y. daro reakciją veiksmingą.

Kompleksinė reakcija, remiantis alkoholių savybe šarminėje aplinkoje su vario (II) sulfatu sudaryti spalvotus kompleksinius junginius.

Jis naudojamas identifikuoti daugiahidroksilį alkoholį - glicerolį ir efedrino hidrochloridą, kuriame, be alkoholio hidroksilo, komplekso formavime dalyvauja ir antrinė aminų grupė.
Fenolio hidroksilas yra hidroksilas, prijungtas prie aromatinio radikalo. Jame yra vaistų grupės fenoliai (fenolis, rezorcinolis); fenolio rūgštys ir jų dariniai (salicilo rūgštis, fenilsalicilatas, salicilamidas, oksafenamidas); fenantreno izochinolino dariniai (morfino hidrochloridas, apomorfinas); sinestrolis, adrenalinas, mezatonas ir kt.
Fenolinio hidroksilo turinčių junginių chemines savybes lemia elektronų poros sąveika su aromatinio žiedo π elektronais. Dėl šios sąveikos elektronų tankis pasislenka iš OH grupės į žiedą, sutrinka tolygus elektronų pasiskirstymas jame ir susidaro perteklinis neigiamas krūvis orto ir para padėtyse. Hidroksi grupės vandenilio atomas jonizuojasi ir suteikia fenoliams silpnų rūgščių savybių, kurios vis dėlto retai naudojamos analizei. Didžiausią reikšmę turi vandenilio elektrofilinio pakeitimo reakcijos aromatinio žiedo o ir n padėtyse.
Remiantis fenolio hidroksilo savybėmis, naudojamos šios reakcijos:
Kompleksavimas;
Brominimas;
Azozių deriniai;
Oksidacija;
Indofenolio dažų susidarymas;
Kondensatas
1. Kompleksinės reakcijos fenolio hidroksilas su geležies (III) jonais. Jis pagrįstas fenolio hidroksilo savybėmis sudaryti tirpius kompleksinius junginius, dažnai mėlynus (fenolis) arba violetinius (rezorcinolis, salicilo rūgštis), rečiau raudoną (PAS - natrio druską) ir žalią (chinozolį).
Komplekso sudėtį, taigi ir spalvą, lemia fenolio hidroksilų kiekis (fenolis - mėlynas, rezorcinolis - violetinis) ir kitų funkcinių grupių įtaka.

2. Brominimo reakcija aromatinis žiedas. Jis pagrįstas elektrofiliniu vandenilio pakeitimu o ir n padėtyje bromu, kad susidarytų netirpus bromo darinys.
 Pagrindinės bromavimo taisyklės
Pagrindinės bromavimo taisyklės
Bromas pakeičia vandenilį o ir n padėtyse fenolio hidroksilo atžvilgiu (efektyviausia n padėtis):
 - jei aromatinio žiedo o arba n padėtyse yra pakaitų, į reakciją patenka mažiau bromo atomų:
- jei aromatinio žiedo o arba n padėtyse yra pakaitų, į reakciją patenka mažiau bromo atomų:
 - jei o arba n- padėtyse yra karboksilo grupė, tada, esant bromo pertekliui, vyksta dekarboksilinimas ir susidaro tribromo darinys:
- jei o arba n- padėtyse yra karboksilo grupė, tada, esant bromo pertekliui, vyksta dekarboksilinimas ir susidaro tribromo darinys:
Jei pakaitas yra m padėtyje, tai netrukdo susidaryti tribromo dariniui:

Jei junginyje yra du fenolio hidroksilai m padėtyje, tai dėl jų nuoseklios orientacijos susidaro tribromo darinys

jei dvi hidroksilo grupės yra viena kitos atžvilgiu o arba n padėtyje, jos veikia nenuosekliai: nevyksta brominimas:

3.Azo sujungimo reakcija fenoliai su diazoreagentu (diazotuota sulfanilo rūgštimi), kad susidarytų azodažiklis, oranžinės-raudonos spalvos.

4. Oksidacijos reakcija. Fenoliai gali būti oksiduojami į įvairius junginius, bet dažniausiai į chinonus, nuspalvintus rožine ar rečiau geltona spalva.


5. Indofenolio dažų susidarymo reakcija. Jis pagrįstas fenolių oksidacija į chinonus, kurie kondensuojantis su amoniaku arba amino dariniais ir fenolio pertekliumi sudaro indofenolinį dažiklį, spalvotą violetinę.


6. Kondensacijos reakcija su aldehidais arba rūgšties anhidridais:
Su formaldehidu, esant koncentruotai sieros rūgščiai, susidaro raudonos spalvos aurino (arilmetano) dažai.
Reakcija atitinka salicilo rūgšties farmakopėją.

Koncentruota sieros rūgštis atlieka vandens šalinimo agento vaidmenį pirmajame reakcijos etape, o veikia kaip oksidatorius antroje.
Reakcijos į rezorcinolį chemija

Monohidroliai fenoliai (arenoliai). Nomenklatūra. Izomerizmas. Gavimo būdai. Fizinės savybės ir struktūra. Cheminės savybės: rūgštingumas, fenolatų, eterių ir esterių susidarymas; nukleofilinis hidroksilo grupės pakaitalas; reakcijos su elektrofiliniais reagentais (halogeninimas, nitrinimas, nitrozavimas, azo jungimas, sulfoninimas, acilinimas ir alkilinimas); sąveika su formaldehidu, fenolio-formaldehido dervomis; oksidacijos ir hidrinimo reakcijos.
Diatominiai fenoliai (arendioliai): pirokatecholis, rezorcinolis, hidrochinonas. Paruošimo būdai, savybės ir pritaikymas.
Trihidroksiliai fenoliai (arenetrioliai): pirogalolis, hidroksihidrochinonas, florogliucinolis. Paruošimo būdai, savybės ir pritaikymas.
Arenų hidroksilo dariniai
Fenoliai yra aromatinių angliavandenilių dariniai, kuriuose viena ar daugiau hidroksilo grupių yra tiesiogiai susietos su benzeno žiedu.
Atsižvelgiant į hidroksilo grupių skaičių branduolyje, išskiriami vieno, dviejų ir triatomių fenoliai.
Fenoliams įvardyti dažnai vartojami trivialūs pavadinimai (fenolis, krezoliai, pirokatecholis, rezorcinolis, hidrochinonas, pirogalolis, hidroksihidrochinonas, florogliucinolis).
Pakeisti fenoliai vadinami fenolio dariniais arba atitinkamo aromatinio angliavandenilio hidroksi dariniais.
Monohidriniai fenoliai (arenoliai) Ar-OH
orto-krezolis meta-krezolis para-krezolis
2-metilfenolis 3-metilfenolis 4-metilfenolis
2-hidroksitoluenas 3-hidroksitoluenas 4-hidroksitoluenas
Aromatinėje serijoje taip pat yra junginių, kurių šoninėje grandinėje yra hidroksilo grupė - vadinamieji aromatiniai alkoholiai.
Aromatiniuose alkoholiuose esančios hidroksilo grupės savybės nesiskiria nuo alifatinių alkoholių savybių.
Diatominiai fenoliai (arendioliai)

pirotechino rezorcinolio hidrochinonas
1,2-dihidroksibenzenas 1,3-dihidroksibenzenas 1,4-dihidroksibenzenas
Trihidroliai fenoliai (arenetrioliai)

pirogalolis hidroksihidrochinonas florogliucinolis
1,2,3-trihidroksibenzenas 1,2,4-trihidroksibenzenas 1,3,5-trihidroksibenzenas
Monohidriniai fenoliai
Gavimo būdai
Natūralus fenolio ir jo homologų šaltinis yra akmens anglis, kurią sauso distiliavimo metu susidaro akmens anglių derva. Kai derva distiliuojama, gaunama „karbolinės alyvos“ frakcija (t 0 160–230 0 C), turinti fenolio ir krezolių.
1. Aromatinių sulfonrūgščių druskų suliejimas su šarmais
Reakcija grindžiama pramoniniais fenolių gamybos metodais.
Reakcija susideda iš benzensulfonrūgšties kaitinimo kietu šarmu (NaOH, KOH) 250-300 0 C temperatūroje:
Reakcija vyksta nukleofilinio pakeitimo mechanizmu S N 2 aromatas(prisegimas-atsirišimas).
Elektronus ištraukiančių pakaitų buvimas orto ir para padėtyse, palyginti su pakeitimo vieta, palengvina nukleofilinės pakeitimo reakciją.
2. Arilhalogenidų hidrolizė
Arilo halogenidai, kuriuose nėra aktyvuojančių elektronus sutraukiančių pakaitų, reaguoja labai atšiauriomis sąlygomis.
Taigi, chlorbenzenas hidrolizuojasi, kad susidarytų fenolis, veikiant koncentruotam šarmui, esant 350–400 0 C temperatūrai ir aukštam 30 MPa slėgiui, arba esant katalizatoriams - vario druskoms ir aukštai temperatūrai:

Reakcija vyksta nukleofilinio pakeitimo (eliminacijos-pridėjimo) mechanizmu (arino arba kine mechanizmas).
Elektronus ištraukiančių pakaitų buvimas orto ir para padėtyse halogeno atžvilgiu žymiai palengvina hidrolizės reakciją.
Taigi, para-nitrochlorbenzenas gali pakeisti chlorą hidroksilu įprastu kaitinimu šarminiu tirpalu esant atmosferos slėgiui:
 para-nitrochlorbenzenas para-nitrofenolis
para-nitrochlorbenzenas para-nitrofenolis
Reakcija vyksta pagal mechanizmą S N 2
aromatas(prisegimas-atsirišimas).
3. Fenolio gavimas iš kumeno (kumeno metodas)
Sintezė kumeno pagrindu yra pramoninės svarbos ir vertinga, nes leidžia vienu metu iš pigių žaliavų (naftos, naftos krekingo dujų) gauti du techniškai svarbius produktus (fenolį ir acetoną).
Kumenas (izopropilbenzenas), oksiduojantis atmosferos deguonimi, virsta hidroperoksidu, kuris, veikiamas vandeninio rūgšties tirpalo, suyra, sudarydamas fenolį ir acetoną: 
hidroperoksidas fenolio acetonas
4. Arenų hidroksilinimas
Norint tiesiogiai įvesti hidroksilo grupę į benzeno žiedą, vandenilio peroksidas naudojamas esant katalizatoriams (geležies (I) arba vario (I) druskoms):
5. Oksidacinis karboksirūgščių dekarboksilinimas
Fenoliai gaunami iš aromatinių rūgščių, leidžiant į reaktorių vandens garus ir orą, kurio temperatūra 200-300 0 C, esant vario druskoms (P):
6. Preparatas iš diazonio druskų
Kai arendiazonio druskos kaitinamos vandeniniuose tirpaluose, išsiskiria azotas, kad susidarytų fenoliai: 
Fenolių fizinės savybės
Paprasčiausi fenoliai normaliomis sąlygomis yra mažai tirpstančios, bespalvės kristalinės medžiagos, turinčios būdingą kvapą.
Fenoliai mažai tirpsta vandenyje, bet labai gerai tirpsta organiniuose tirpikliuose. Laikant ore, jie tamsėja dėl oksidacijos procesų.
Jie yra toksiškos medžiagos ir sukelia odos nudegimus.
Elektroninė fenolio struktūra
Elektronų tankio struktūrą ir pasiskirstymą fenolio molekulėje galima pavaizduoti tokia diagrama:

Hidroksilo grupė yra 1-osios rūšies pakaitas, t.y. elektronus dovanojantis pakaitalas.
Taip yra dėl to, kad viena iš vienišų hidroksilo deguonies atomo elektronų porų patenka į p,π-konjugaciją su benzeno žiedo π-sistema, parodydama +M efektą.
Kita vertus, hidroksilo grupė dėl didesnio deguonies elektronegatyvumo turi –I efektą.
Tačiau +M efektas fenoliuose yra daug stipresnis nei priešingai nukreiptas –I efektas (+M > -I).
Sukabinimo efekto rezultatas yra:
1) O-H ryšio poliškumo padidėjimas, dėl kurio, palyginti su alkoholiais, padidėja fenolių rūgštinės savybės;
2) dėl konjugacijos C-OH ryšys fenoliuose tampa trumpesnis ir stipresnis, palyginti su alkoholiais, nes jis iš dalies yra dvigubas. Todėl OH grupės pakeitimo reakcijos yra sunkios;
3) elektronų tankio padidėjimas ant anglies atomų benzeno žiedo orto ir para padėtyse palengvina vandenilio atomų elektrofilinio pakeitimo reakcijas šiose padėtyse.

Cheminės fenolių savybės
Chemines fenolių savybes lemia hidroksilo grupės ir benzeno žiedo buvimas molekulėje.
1. Hidroksilo grupės reakcijos
1. Rūgštinės savybės
Fenoliai yra silpnos OH rūgštys, bet daug stipresnės už alkanolius. Rūgštingumo konstanta rK A fenolis yra lygus 10.
Didesnis fenolio rūgštingumas paaiškinamas dviem veiksniais:
1) didesnis fenolio O-H jungties poliškumas, dėl kurio hidroksilo grupės vandenilio atomas įgauna didesnį mobilumą ir gali būti pašalintas protono pavidalu, kad susidarytų fenolato jonas;
2) Fenolato jonas mezomeriškai stabilizuojasi dėl deguonies vienišos poros konjugacijos su benzeno žiedu, t.y. neigiamas fenolato jono deguonies atomo krūvis yra žymiai delokalizuotas:

Nė viena iš šių ribinių struktūrų vien neapibūdina tikrosios molekulės būsenos, tačiau jų naudojimas leidžia paaiškinti daugybę reakcijų.
Elektronus ištraukiantys pakaitalai padidina fenolio rūgštines savybes.
Ištraukdami elektronų tankį iš benzeno branduolio link savęs, jie sustiprina p,π-konjugaciją (+M efektas), taip padidindami OH jungties poliarizaciją ir padidindami hidroksilo grupės vandenilio atomo judrumą.
Pavyzdžiui:
 fenolis 2-nitrofenolis 2,4-dinitrofenolis pikrino rūgštis
fenolis 2-nitrofenolis 2,4-dinitrofenolis pikrino rūgštis
рК а 9,98 7,23 4,03 0,20
Elektronus dovanojantys pakaitalai sumažina fenolių rūgštingumą.
1. Fenolio hidroksilo pakeitimas halogenu
Hidroksilo grupę fenolyje labai sunku pakeisti halogenu.
Kai fenolis reaguoja su fosforo pentachloridu PCl 5, pagrindinis produktas yra trifenilo fosfatas ir susidaro tik nedideli chlorbenzeno kiekiai:
Trifenilfosfatas chlorbenzenas
Elektronus sutraukiančių pakaitų buvimas orto ir para padėtyse hidroksilo atžvilgiu labai palengvina OH grupės nukleofilinio pakeitimo reakcijas.
Taigi pikrino rūgštis tomis pačiomis sąlygomis lengvai paverčiama 2,4,6-trinitrochlorbenzenu (pikrilchloridu):  pikrino rūgštis pikrilchloridas
pikrino rūgštis pikrilchloridas
2. Sąveika su amoniaku
Sąveikaujant su amoniaku aukštesnėje temperatūroje ir slėgyje, esant aliuminio chlorido katalizatoriui, OH grupė pakeičiama NH2 grupe, kad susidarytų anilinas:
 fenolio anilinas
fenolio anilinas
3. Fenolio mažinimas
Kai fenolis redukuojamas ličio aliuminio hidridu, susidaro benzenas:
3. Reakcijos, susijusios su benzeno žiedu
1. Elektrofilinės pakeitimo reakcijos benzeno žiede
Hidroksilo grupė yra 1-osios rūšies pakaitas, todėl elektrofilinės pakeitimo reakcijos benzeno žiede vyksta su fenoliais daug lengviau nei su benzenu, o pakaitai nukreipiami į orto ir para padėtis.

1) Halogeninimo reakcijos
Fenolis lengvai reaguoja su bromo vandeniu kambario temperatūroje, sudarydamas baltas 2,4,6-tribromfenolio nuosėdas:

2,4,6-tribromfenolis
Ši reakcija yra kokybiška fenolių atžvilgiu.
Fenolio chlorinimas vyksta lengvai:

2) Nitravimo reakcijos
Fenolis lengvai nitrinamas praskiesta azoto rūgštimi 0 0 C temperatūroje, kad susidarytų orto ir para izomerų mišinys, kuriame vyrauja orto izomeras: 
orto- ir para-nitrofenoliai
Izomeriniai nitrofenoliai lengvai atskiriami dėl to, kad tik orto izomeras yra lakus su vandens garais.
Didesnis orto-nitrofenolių nepastovumas paaiškinamas intramolekulinių vandenilio ryšių susidarymu, o paraizomeras sudaro tarpmolekulinius vandenilio ryšius: 
Naudojant koncentruotą azoto rūgštį, susidaro 2,4,6-trinitrofenolis (pikrino rūgštis):
 pikrino rūgštis
pikrino rūgštis
3) Sulfoninimo reakcijos
Fenolis lengvai sulfonuojamas kambario temperatūroje su koncentruota sieros rūgštimi, kad susidarytų orto izomeras, kuris aukštesnėje nei 100 0 C temperatūroje persitvarko į paraizomerą:

4) Alkilinimo reakcijos
Fenoliai lengvai patenka į alkilinimo reakcijas.
Halogenalkanai, alkanoliai ir alkenai naudojami kaip alkilinimo agentai, kai yra proto rūgštys (H 2 SO 4, H 3 PO 4) arba Lewis rūgštys (AlCl 3, BF 3): 

5) Acilinimo reakcijos
Fenolių acilinimas vyksta lengvai, veikiant halogeno anhidridams arba karboksirūgšties anhidridams, esant Lewis rūgštims: 
6) Nitrozavimo reakcijos
Nitrozofenoliai gaunami tiesiogiai nitrozuojant fenolius:

para-krezolis orto-nitrozo-para-krezolis
7) Azo jungimosi reakcijos
Derinys su fenoliais veda prie šiek tiek šarminė aplinka, kadangi fenoliato jonas yra daug aktyvesnis nei pats fenolis:

8) Kondensacijos reakcijos
Fenoliai yra tokie aktyvūs elektrofilinių pakeitimo reakcijų komponentai, kad, esant rūgštims ir bazėms, sąveikauja su labai silpnais elektrofilais – aldehidais ir ketonais.
Kondensatas su formaldehidu
Formaldehidas lengviausiai patenka į kondensacijos reakcijas.
Jei fenolio kondensacijos reakcija su formaldehidu vykdoma švelniomis sąlygomis, orto- ir para-hidroksimetilfenolius galima išskirti: Atskiri atstovai
fenolis– kristalinė medžiaga, kurios lyd. 43°C, būdingo aštraus kvapo, sukelia odos nudegimus. Tai vienas pirmųjų antiseptikų, naudojamų medicinoje. Iš jo dideliais kiekiais gaminami plastikai (kondensatas su formaldehidu), vaistai (salicilo rūgštis ir jos dariniai), dažikliai, sprogstamosios medžiagos (pikrino rūgštis).
fenolio metilo eteris - anizolis– naudojamas aromatinėms medžiagoms ir dažams gaminti.
fenolio etilo eteris - fenolis.
Krezoliai (metilfenoliai) naudojamas plastikų, dažiklių ir dezinfekavimo priemonių gamyboje.
Fenolio hidroksilas yra hidroksilas, susietas su aromatiniu žiedu.
1. Rūgščių-šarmų savybės atsiranda dėl to, kad fenolio hidroksile yra judrus vandenilio atomas. Hidroksilo elektronų pora yra pasislinkusi link aromatinio žiedo, todėl rūgštinės savybės yra stipresnės nei alkoholių. Taigi anglies rūgšties pKa = 6,35, o fenolio pKa = 9,89.
Fenoliai ištirpsta vandeniniuose šarmų tirpaluose, kad susidarytų fenolatai (fenoksidai):
Tačiau fenolių rūgštingumas išreiškiamas taip nežymiai, kad net tokia silpna rūgštis kaip anglies rūgštis išstumia fenolius iš jų druskų:
Todėl fenoliai, tirpdami šarmuose, negali ištirpti karbonatuose, nes šiuo atveju išsiskirianti anglies rūgštis iš karto suskaido fenolatą:
Ši fenolių savybė išskiria juos nuo karboksirūgščių.
Kylant temperatūrai, reakcija vyksta į priekį. Šarminių metalų fenolatai, kaip stiprių bazių ir silpnų rūgščių druskos, vandeniniuose tirpaluose dalinai hidrolizuojasi, todėl fenolatų tirpaluose vyksta šarminė reakcija.
2. Esterifikavimo reakcija (panaši į alkoholio hidroksilą).
Eterių susidarymas yra fenolatų ir alkilhalogenidų (arba alkilsulfatų) reakcija.
C 6 H 5 ONa + JCH 3 ® C 6 H 5 OCH 3 + NaJ
Esteriai susidaro natrio fenolatams reaguojant su anhidridais (arba rūgšties chloridais).
3. Redokso savybės.
Fenoliai pasižymi stipriomis redukuojančiomis savybėmis ir yra labai lengvai oksiduojami net silpnų oksidatorių, todėl susidaro spalvoti junginiai su chinoidine struktūra.
 | [O] – CaOCl 2, H 2 O 2, Cl 2, Br 2 |
Oksidacijos reakcijos pavyzdys yra indofenolio dažų susidarymas: susidaręs chinonas, sąveikaujant su NH 3, paverčiamas chinono iminu, kuris reaguoja su nesureagavusiu fenoliu. Esant amoniakui susidaro indofenolis, nusidažo mėlynai.

chinoneimino indofenolis
n- benzochinoneiminas
Indofenolio reakcijos tipas yra Liebermano nitrozo reakcija, būdinga tiems fenoliams, kuriuose nėra pakaitų orto ir para padėtyse.
Rūgščioje aplinkoje veikiamas natrio nitrito susidaro n-nitrozofenolis, izomerizuojantis iki monooksimo n-benzochinonas, kuris rūgštinėje aplinkoje reaguoja su fenolio pertekliumi ir sudaro indofenolį.

Pastebima spalva, kuri pasikeičia, kai pridedamas šarmo tirpalas:
fenolis – tamsiai žalias, virstantis vyšnių raudonumu;
timolis – mėlynai žalias, tampa purpurinis;
rezorcinolis – violetinė-juoda, virsta violetine;
heksestrolas (sinestrol) – raudonai violetinis, virstantis vyšnine.
4. Kompleksavimo reakcija su geležies jonais.
Atsižvelgiant į fenolio hidroksilų kiekį, kitų funkcinių grupių buvimą molekulėje, jų santykinę padėtį, aplinkos pH ir temperatūrą, susidaro įvairios sudėties ir spalvos kompleksiniai junginiai (išskyrus timolį).



Kompleksai yra spalvoti:
fenolis – mėlyna spalva;
rezorcinolis - mėlynai violetinė spalva;
salicilo rūgštis - mėlynai violetinė arba raudonai violetinė spalva;
osalmidas (oksafenamidas) – raudonai violetinė spalva;
natrio para-aminosalicilatas – raudonai violetinė spalva;
quinosol – melsvai žalios spalvos.
Daugumos fenolinių junginių reakcija yra farmakopėjoje.
5. Elektrofilinės pakeitimo reakcijos – vandenilio atomo SE aromatiniame žiede (brominimas, kondensacija su aldehidais, derinimas su diazonio druskomis, nitrinimas, nitrozavimas, jodavimas ir kt.). Fenolių gebėjimas patekti į elektrofilines pakeitimo reakcijas paaiškinamas deguonies atomo vienišos elektronų poros sąveika su benzeno žiedo π-elektronais. Elektronų tankis pasislenka link aromatinio žiedo. Didžiausias elektronų tankio perteklius stebimas anglies atomuose O- Ir n- padėties fenolio hidroksilo atžvilgiu (I tipo orientuojantis).
5.1. Halogeninimo reakcija (brominimas ir jodavimas).
5.1.1. Sąveikaujant su bromo vandeniu susidaro baltos arba geltonos bromo darinių nuosėdos.

Kai yra bromo perteklius, vyksta oksidacija:

Fenolių brominimo reakcija priklauso nuo pakaitų pobūdžio ir padėties.
Jodavimas vyksta panašiai, pavyzdžiui:

5.1.2. Jei yra pakaitalų O- Ir n- aromatinio žiedo padėtyse, reaguoja nepakeisti aromatinio žiedo vandenilio atomai.

5.1.3. Jei į O- Ir n- padėtyse fenolio hidroksilo atžvilgiu yra karboksilo grupė, tada, veikiant bromo pertekliui, vyksta dekarboksilinimas:

5.1.4. Jei junginyje yra du fenolio hidroksilai m- padėtis, tada, veikiant bromo tribromo dariniams, susidaro (nuosekli orientacija):

5.1.5. Jei dvi hidroksilo grupės yra viena kitos atžvilgiu O- arba n- padėties, tada brominimo reakcija nevyksta (nenuosekli orientacija)

5.2. Kondensacijos reakcijos
5.2.1. Su aldehidais.
Fenolių kondensacijos su aldehidais pavyzdys yra reakcija su Marquis reagentu. Kaitinant fenolius formaldehido tirpalu, esant koncentruotam H 2 SO 4, susidaro bespalviai kondensacijos produktai, kuriuos oksiduojant susidaro intensyvios spalvos chinoidinės struktūros junginiai. Sieros rūgštis šioje reakcijoje atlieka dehidratuojančios, kondensuojančios ir oksiduojančios medžiagos vaidmenį.

5.2.2. Fenolių reakcija su chloroformu (CHCl 3) susidaro ausino dažai.
Kai fenoliai kaitinami CHCl3 šarminėje aplinkoje, aurines– trifenilmetano dažikliai:

Aurinai yra spalvoti:
fenolis – geltona spalva;
timolis – geltona spalva virsta purpurine;
rezorcinolis – raudonai violetinė spalva.
5.2.3. Su rūgšties anhidridais.
A. Fluoresceino susidarymo reakcija (rezorcinolio kondensacija su ftalio anhidridu).


B. Fenolftaleino susidarymo reakcija (fenolio kondensacija su ftalio anhidridu).

Esant dideliam šarmų pertekliui, susidaro tripakeista natrio druska.
Timolio kondensacija su ftalio anhidridu vyksta panašiai kaip fenolftaleino susidarymo reakcija, kuri šarminėje terpėje yra mėlyna.
5.3. Nitravimo reakcija
Fenoliai reaguoja su praskiesta azoto rūgštimi (HNO 3) ir sudaro orto- ir para-nitro darinius. Pridėjus natrio hidroksido tirpalo, spalva pagerėja, nes susidaro gerai disocijuota druska.

5.4. Fenolių azojungimo su diazonio druska reakcija šarminėje terpėje.
Kai fenoliai reaguoja su diazonio druska, kai pH 9-10, susidaro azodažai, nusidažo geltonai oranžine arba raudona spalva. Azo jungties reakcija vyksta orto ir para padėtyse fenolio hidroksilo atžvilgiu. Diazotuota sulfanilo rūgštis paprastai naudojama kaip diazoreagentas.


Įvadas
Dauguma medicinos praktikoje naudojamų vaistų yra organiniai junginiai. Tokių medžiagų tapatumą patvirtina reakcijos į funkcines grupes.
Funkcinė grupė yra reaktyvus atomas, atomų grupė arba reakcijos centras organinio junginio molekulėje.
Bendras funkcinės analizės principas – nustatytinoms grupėms būdingų reakcijų panaudojimas. Reakcija turi būti ne tik kiek įmanoma specifiškesnė, bet ir pakankamai greita, joje turi būti lengvai identifikuojamas reagentas arba reakcijos produktas.

Alkoholio hidroksilo identifikavimas
Alkoholiai - Tai angliavandenilių dariniai, kurių molekulėse vienas ar keli vandenilio atomai pakeisti hidroksilo grupėmis. Apskritai alkoholio molekulė gali būti pavaizduota kaip ROH.
Esterių susidarymo reakcija
Alkoholiai sudaro esterius su organinėmis rūgštimis arba rūgščių anhidridais, esant vandenį šalinančioms medžiagoms (pavyzdžiui, koncentruotai sieros rūgščiai). Esteriai, gauti iš mažos molekulinės masės alkoholių, turi būdingą kvapą, o didelės molekulinės masės alkoholių pagrindu pagaminti esteriai yra kristalinės medžiagos, turinčios aiškią lydymosi temperatūrą.
Metodika. Į 1 ml etanolio įlašinti 5 lašus ledinės acto rūgšties, 0,5 ml koncentruotos sieros rūgšties ir atsargiai pakaitinti; aptinkamas būdingas etilacetato (šviežių obuolių) kvapas.

Alkoholių oksidacijos reakcija į aldehidus
Susidarę aldehidai aptinkami pagal kvapą. Kaip oksidatoriai naudojami kalio heksaciano-(III)-feratas, kalio permanganatas, kalio dichromatas ir kt.
Metodika. Į pirmąjį mėgintuvėlį įlašinkite 2 lašus etanolio, 1 lašą 10 % sieros rūgšties tirpalo ir 2 lašus 10 % kalio dichromato tirpalo. Gautas sprendimas turi oranžinė spalva. Kaitinkite ant ugnies, kol tirpalas pradės kauptis melsvai žalios spalvos(tuo pačiu jaučiamas būdingas acetaldehido kvapas, primenantis Antonovo obuolių kvapą). Įpilkite 1 lašą gauto tirpalo į antrą mėgintuvėlį su 3 lašais fuksino sieros rūgšties. Pasirodo rožinė-violetinė spalva.
Kompleksinių junginių susidarymo reakcija
Daugiahidroksiliai alkoholiai sudaro mėlynus kompleksinius junginius su vario sulfatu šarminėje terpėje (su Felingo reagentu).
Metodika. Į 0,5 ml glicerino įlašinti 5 lašus natrio hidroksido ir vario (II) sulfato, intensyvaus mėlynas dažymas.

Fenolio hidroksilo identifikavimas
Reakcija su geležies (111) chloridu
Būdinga kokybinė reakcija į fenolius yra reakcija su geležies (III) chloridu. Atsižvelgiant į fenolio hidroksilų kiekį, kitų funkcinių grupių buvimą fenolio molekulėje, jų santykinę padėtį, aplinkos pH ir temperatūrą, susidaro įvairios sudėties ir spalvos kompleksiniai junginiai.
Metodika. Į 0,01 g vaisto, ištirpinto 1 ml vandens (fenoliui, rezorcinoliui), įlašinti 2 lašus geležies (III) chlorido tirpalo – pastebima būdinga spalva (1 lentelė).
1 lentelė. Preparatų kompleksų dažymas geležies (III) chloridu
|
Vaistas |
Tirpiklis |
Komplekso dažymas |
|
Violetinė |
||
|
Rezorcinolis |
Mėlyna-violetinė |
|
|
Adrenalino hidrochloridas |
Smaragdo žalia, nuo vieno lašo amoniako tirpalo įpylimo virsta vyšnių raudona, o paskui oranžine raudona. |
|
|
Morfino hidrochloridas |
Mėlyna, išnyksta pridedant praskiestos acto arba druskos rūgšties |
|
|
Paracetamolis |
Mėlyna-violetinė |
|
|
Piridoksino hidrochloridas |
Raudona, nykstanti įpylus praskiestos druskos rūgšties ir neišnykstanti su praskiesta acto rūgštimi. |
|
|
Salicilo rūgštis ir natrio salicilatas |
Mėlyna-violetinė, neišnyksta įlašinus kelis lašus praskiestos druskos arba acto rūgšties. |
|
|
Fenil salicilatas |
violetinė, išnyksta nuo praskiestos druskos arba acto rūgšties pridėjimo ir virsta kraujo raudonisįlašinant 1-2 lašus amoniako tirpalo. |
Naudodami amoniako tirpalą galite atskirti fenolį nuo rezorcinolio. Rezorcinolio komplekso su geležimi spalva įdėjus reagento pasikeičia rusvai geltona.