Фенольные гидроксильные группы и антиоксидантная активность. Реакция окисления спиртов до альдегидов Реакции по гидроксильной группе
Фенольный гидроксил – это гидроксил, связанный с ароматическим радикалом. Его содержат ЛВ группы фенолов (фенол, резорцин); фенолокислот и их производных (кислота салициловая, фенилсалицилат, салициламид, оксафенамид); производные фенантренизохинолина (морфина гидрохлорид, апоморфин); синэстрол, адреналин и др.
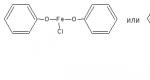
Химические свойства соединений, содержащих фенольный гидроксил, обусловлены взаимодействием электронной пары с π-электронами ароматического кольца. Это взаимодействие приводит к смещению электронной плотности с ОН-группы на кольцо, нарушению в нём равномерности распределения электронов, созданию избыточного отрицательного заряда в орто (о )- и пара (п )-положениях. Атом водорода гидроксигруппы ионизирует и придаёт фенолам слабые кислотные свойства (рКа фенола = 10,0; рКа резорцина = 9,44). Поэтому, в отличие от спиртов, они образуют соли со щелочами (при рН 12-13), растворимые комплексные соединения с хлоридом железа (III) (в нейтральных, слабощелочных и кислых растворах).
Фенолы проявляют сильные восстановительные свойства, очень легко окисляются даже слабыми окислителями. Образуют окрашенные соединения хиноидной структуры.
Наибольшее значение имеют реакции электрофильного замещения водородов в о - и п -положениях ароматического кольца – галогенирование (бромирование), конденсация с альдегидами, нитрование, сочетание с солями диазония.
На основе свойств фенольного гидроксила и активированного им ароматического кольца в анализе ЛВ используются следующие реакции:
1 – комплексообразования;
2 – галогенирования (бромирования);
3 – азосочетания;
4 – окисления;
5 – образования индофенолового красителя;
6 – конденсации с альдегидами.
Идентификация
2.1. Реакция комплексообразования с ионами железа (III )
Основана на свойствах фенольного гидроксила образовывать растворимые комплексные соединения, окрашенные чаще в синий (фенол) или фиолетовый цвет (резорцин, кислота салициловая) реже в красный (ПАСК – натрия) и зелёный (хинозол, адреналин).
Состав комплексов, а, следовательно, и их окраска обусловлены количеством фенольных гидроксилов, влиянием других функциональных групп, реакцией среды.
При избытке фенола:

Предположительный состав конечного продукта в реакции с фенолом:


2.2. Реакция бромирования ароматического кольца
Основана на электрофильном замещении водорода в о- и п- положениях на бром с образованием нерастворимого бромпроизводного (белый осадок).

Основные правила бромирования:
Бром замещает водород в о- и п- положениях по отношению к фенольному гидроксилу (наиболее реакционноспособное – п- положение):

При наличии в о- или п- положениях ароматического кольца заместителей, в реакцию вступает меньше атомов брома;
Если в о- или п- положениях находится карбоксильная группа, то при наличии избытка брома происходит декарбоксилирование и образование трибромпроизводного:

Если заместитель находится в м- положении, то он не препятствует образованию трибромпроизводного:

Если в соединении содержится два фенольных гидроксила в м- положении, то в результате их согласованной ориентации образуется трибромпроизводное:

Если две гидроксильные группы расположены в о- или п- положениях друг к другу, то они действуют несогласованно: бромирование количественно не проходит:

Если кроме фенольных гидроксилов соединение содержит амидную или сложно-эфирную группу (салициламид, фенилсалицилат) для их количественной оценки методом броматометрии необходимо провести предварительный гидролиз.
2.3. Реакция азосочетания
Сочетание идет также в о- и п- положениях, в этом случае также, как и при бромировании, предпочтительным является п- положение. Диазореактив – соль диазония (диазотированная сульфаниловая кислота). Среда – щелочная. Продукт реакции – азокраситель.

2.4. Реакция окисления
Фенолы могут окисляться до различных соединений, но чаще всего до о - или п -хинонов (циклических дикетонов),окрашенных в розовый или реже в жёлтый цвет.


2.5. Реакция образования индофенолового красителя
Основана на окислении фенолов до хинонов, которые при конденсации с аммиаком или аминопроизводным и избытком фенола образуют индофеноловый краситель, окрашенный в фиолетовый цвет.


Разновидностью данной реакции является нитрозореакция Либермана, она характерна для фенолов, не имеющих заместителей в о- и п- положениях.
При действии нитрита натрия в кислой среде образуется п -нитрозофенол, изомеризующийся в п- хиноидоксим, который, реагируя с избытком фенола в кислой среде, образует индофенол:

2.6. Образование нитрозосоединений
При взаимодействии с разведенной азотной кислотой фенолы могут нитроваться при комнатной температуре, образуя о- и п- нитропроизводные. Образующееся нитропроизводное содержит в п- положении подвижный атом водорода гидроксильной группы, образуется таутомерная аци-форма с хиноидной структурой, она обычно окрашена в желтый цвет. Добавление щелочи усиливает окраску, вследствие образования хорошо диссоциируемой соли:

2.7. Реакция конденсации с альдегидами или ангидридами кислот
С формальдегидом в присутствии концентрированной серной кислоты с образованием ауринового (арилметанового) красителя окрашенного в красный цвет.
Реакция является фармакопейной для кислоты салициловой. Концентрированная серная кислота на первой стадии реакции играет роль водоотнимающего средства, на второй – является окислителем.
С фталевым ангидридом (сплавление и последующее растворение плава в щёлочи) рекомендована фармакопеей для идентификации фенола и резорцина.

Количественное определение
2.8. Броматометрия
Метод основан на электрофильном замещении атомов водорода ароматического кольца на бром, выделенный в реакции бромата калия с бромидом калия в кислой среде.
K BrO 3
+
5KBr
+ 6 HCl
→ 3Br 2
+
6KCl
+ 3H 2 O
BrO 3
+
5KBr
+ 6 HCl
→ 3Br 2
+
6KCl
+ 3H 2 O
Используют способы прямого и обратного титрования. В прямом – титруют броматом калия в присутствии бромида калия с индикатором метиловым оранжевым или метиловым красным от розовой окраски до обесцвечивания. В точке эквивалентности избыточная капля бромата калия выделяет бром, который окисляет индикатор и раствор обесцвечивается. При обратном титровании вводят избыток бромата калия, добавляют калия бромид, создают кислую среду, выдерживают нужное для бромирования время и после чего избыток брома определяют йодометрически (индикатор – крахмал).
Br 2 + 2KI → I 2 + 2KBr
I 2 + 2Na 2 S 2 O 3 → Na 2 S 4 O 6 + 2NaI
Способом прямого титрования определяют по ГФ Х тимол, обратного – фенол, резорцин, кислоту салициловую, синэстрол и другие ЛВ.
М.э. = ¼ М.м. (тимол)
М.э. = 1/6 М.м. (фенол, резорцин, кислота салициловая)
М.э. = 1/8 М.м. (синэстрол)
2.9. Йодометрия
Основана на электрофильном замещении атомов водорода ароматического кольца на йод.

Для связывания йодоводородной кислоты, смещающей равновесие в обратную сторону, добавляют ацетат или гидрокарбонат натрия.
HI + NaHCO 3 → NaI + H 2 O + CO 2
HI + CH 3 COONa → NaI + CH 3 COOH
Используют способы прямого и обратного титрования. В последнем – избыток йода оттитровывают тиосульфатом натрия.
I 2 + 2NaS 2 O 3 → 2NaI + Na 2 S 4 O 6
М.э. = 1/6 М.м. (фенол)
2.10. Йодхлорметрия
Метод основан на электрофильном замещении атомов водорода ароматического кольца на йод, входящий в состав йодмонохлорида.

Используют способ обратного титрования – избыток йодмонохлорида определяют йодометрически.
ICl + KI → I 2 + KCl
I 2 + 2Na 2 S 2 O 6 → 2NaI + Na 2 S 4 O 6
М.э. = 1/6 М.м. (фенол)
2.11. Метод ацетилирования
Используют по ГФ Х для количественной оценки синэстрола.

М.э. = ½ М.м.
2.12. Алкалиметрический метод нейтрализации в среде протофильного растворителя диметилформамида (ДМФА).
ЛВ группы фенолов проявляют очень слабые кислотные свойства, их определение алкалиметрическим методом нейтрализации в водных или смешанных средах невозможно, поэтому используют титрование в среде неводных растворителей, в частности, ДМФА. Метод основан на солеобразовании определяемой слабой кислоты (фенола) с титрантом (метилатом натрия) в среде протофильного растворителя, усиливающего кислотные свойства.

Суммарно:

2.13. Фотоколориметрия (ФЭК) и спектрофотометрия (СФМ)
Основана на свойстве окрашенных растворов поглощать немонохроматический (ФЭК) или монохроматический (СФМ) свет в видимой области спектра.
Получение окрашенных растворов;
Измерение оптической плотности (D), характеризующей поглощение электромагнитного излучения раствором, содержащим анализируемое вещество;
Проведение расчётов на основе основного закона светопоглощения с использованием калибровочного графика, удельного коэффициента поглощения, раствора стандартного образца.
При определении этими методами ЛВ, содержащих фенольный гидроксил, получают окрашенные соединения на основе реакций комплексообразования с ионами железа (III), азосочетания с солями диазония и образования индофенолового красителя.
Лекция № 14
Тема « Качественные реакции на функциональные группы»
1) Гидроксильная (спиртовая, фенольная)
2) Карбонильная (альдегидная, карбоксильная, сложно-эфирная)
3) Первичная ароматическая аминогруппа, третичная аминогруппа(третичный азот)
4) Имидная, сульфамидная.
Функциональные группы (ФГ)- это связанные с углеродным радикалом отдельные атомы или группы атомов, которые вследствие своих характерных свойств могут быть использованы определения лекарственных веществ.
I. Спиртовой гидроксил . Alr-OH - это гидроксил, связанный с алифатическим углеводородным радикалом.
На основе спиртового гидроксила в анализе содержащих его ЛВ используются следующие реакции:
Этерификации (образования с кислотами или их ангидридами сложных эфиров);
Окисление до альдегидов, а в некоторых случаях и до кислот;
Комплексообразование с ионами меди (II) в щелочной среде.
1.Реакция этерификации в присутствии водоотнимающих средств с кислотами или их ангидридами. Основана на свойстве спиртов образовывать сложные эфиры. В случае низкомолекулярных соединений эфиры обнаруживают по запаху, при анализе ЛВ с высокой молекулярной массой – по температуре плавления.
Реакция этерификации является фармакопейной для спирта этилового.
CH 3 CH 2 OH + CH 3 COOH H 2 SO 4 → CH 3 CH 2 OCOCH 3
2. Реакция окисления, основана на свойстве спиртов окисляться до альдегидов, которые обнаруживают по запаху. В качестве реагентов используют различные окислители: калия перманганат, калия бихромат, гексацианоферрат (III) калия и др. Наибольшую аналитическую ценность имеет калия перманганат, который, восстанавливаясь, меняет степень окисления от +7 до + 2 и обесцвечивается, т.е. делает реакцию эффектной.

Реакция комплексообразования , основанная на свойстве спиртов образовывать окрашенные комплексные соединения с сульфатом меди (II) в щелочной среде.

Используется для идентификации многоатомного спирта – глицерина и эфедрина гидрохлорида, в котором кроме спиртового гидроксила участвует в комплексообразовании и вторичная аминная группа.
Фенольный гидроксил - это гидроксил, связанный с ароматическим радикалом. Его содержат ЛВ группы фенолы (фенол, резорцин); фенолокислот и их производных (кислота салициловая, фенилсалицилат, салициламид, оксафенамид); производные фенантренизохинолина (морфин гидрохлорид, апоморфин); синестрол, адреналин, мезатон и др.
Химические свойства соединений, содержащих фенольный гидроксил, обусловлены взаимодействием электронной пары с π – электронами ароматического кольца. Это взаимодействие приводит к смещению электронной плотности с ОН - – группы на кольцо, нарушения в нем равномерности распределения электронов, созданию избыточного отрицательного заряда в орто- и пара- положениях. Атом водорода гидроксигруппы ионизирует и придает фенолам слабые кислотные свойства, которые однако редко используются в анализе. наибольшее значение имеют реакции электрофильного замещения водородов в о- и n- положениях ароматического кольца.
На основе свойств фенольного гидроксила используются следующие реакции:
Комплексообразования;
Бромирования;
Азосочетания;
Окисления;
Образования индофенолового красителя;
Конденсации
1. Реакции комплексообразования фенольного гидроксила с ионами железа (III). Основана на свойствах фенольного гидроксила образовывать растворимые комплексные соединения, окрашенные чаще в синий (фенол) или фиолетовый цвет (резорцин, кислота салициловая), реже в красный (ПАСК – натрия) и зеленый (хинозол).
Состав комплекса, а, следовательно, и их окраска обусловлены количеством фенольных гидроксилов (фенол – синее, резорцин – фиолетовое), и влиянием других функциональных групп.

2. Реакция бромирования ароматического кольца. Основана на электрофильном замещении водорода в о- и n- положении на бром с образованием нерастворимого бромопроизводного.
 Основные правила бромирования
Основные правила бромирования
Бром замещает водород в о- и n- положении по отношению к фенольному гидроксилу (наиболее рационноспособное n – положение):
 - при наличии в о- или n- положениях ароматического кольца заместителей в реакцию вступает меньше атомов брома:
- при наличии в о- или n- положениях ароматического кольца заместителей в реакцию вступает меньше атомов брома:
 - если в о- или n- положениях находиться карбоксильная группа, то при наличии избытка брома происходит декарбоксилирование и образование трибромпроизводного:
- если в о- или n- положениях находиться карбоксильная группа, то при наличии избытка брома происходит декарбоксилирование и образование трибромпроизводного:
Если заместитель находится в м- положении, то он не препятствует образованию трибромпроизводного:

Если в соединении содержится два фенольных гидроксила в м- положении, то в результате их согласной ориентации образуется трибромпроизводное

если две гидроксильные группы расположены в о- или n- положении друг к другу, то они действуют несогласованно: бромирование не происходит:

3.Реакция азосочетания фенолов с диазореактивом (диазотированная сульфаниловая кислота) с образованием азокрасителя, окрашенного в оранжево-красный цвет.

4. Реакция окисления. Фенолы могут окисляться до различных соединений, но чаще всего до хинонов окрашенных в розовый или реже в желтый цвет.


5. Реакция образования индофенолового красителя. Основана на окислении фенолов до хинонов, которые при конденсации с аммиаком или аминопроизводными и избытком фенола образуют индофеноловый краситель, окрашенный в фиолетовый цвет.


6. Реакция конденсации с альдегидами или ангидридами кислот:
С формальдегидом в присутствии концентрированной серной кислоты с образованием ауриноваго (арилметанового) красителя окрашенного в красный цвет.
Реакция является фармакопейной для кислоты салициловой.

Концентрированная серная кислота на первой стадии реакции играет роль водоотнимающего средства, на второй – является окислителем.
Химизм реакции на резорцин

Одноатомные фенолы (аренолы). Номенклатура. Изомерия. Способы получения. Физические свойства и строение. Химические свойства: кислотность, образование фенолятов , простых и сложных эфиров; нуклеофильное замещение гидроксильной группы; реакции с электрофильными реагентами (галогенирование, нитрование, нитрозирование, азосочетание, сульфирование, ацилирование и алкилирование); взаимодействие с формальдегидом, фенолформальдегидные смолы; реакции окисления и гидрирования.
Двухатомные фенолы (арендиолы): пирокатехин, резорцин, гидрохинон. Способы получения, свойства и применение.
Трехатомные фенолы (арентриолы): пирогаллол, оксигидрохинон, флороглюцин. Способы получения, свойства и применение.
Гидроксильные производные аренов
Фенолы – это производные ароматических углеводородов, в которых одна или несколько гидроксильных групп непосредственно связаны с бензольным ядром.
В зависимости от числа гидроксильных групп в ядре различают одно-, двух- и трехатомные фенолы.
Для названия фенолов часто используют тривиальные названия (фенол, крезолы, пирокатехин, резорцин, гидрохинон, пирогаллол, гидроксигидрохинон, флороглюцин).
Замещенные фенолы называют как производные фенола или как гидроксипроизводные соответствующего ароматического углеводорода.
Одноатомные фенолы (аренолы) Ar-OH
орто-крезол мета-крезол пара-крезол
2-метилфенол 3-метилфенол 4-метилфенол
2-гидрокситолуол 3-гидрокситолуол 4-гидрокситолуол
В ароматическом ряду встречаются также соединения с гидроксильной группой в боковой цепи – так называемые ароматические спирты.
Свойства гидроксильной группы в ароматических спиртах не отличаются от свойств спиртов алифатического ряда.
Двухатомные фенолы (арендиолы)

пирокатехин резорцин гидрохинон
1,2-дигидроксибензол 1,3-дигидроксибензол 1,4-дигидроксибензол
Трехатомные фенолы (арентриолы)

пирогаллол гидроксигидрохинон флороглюцин
1,2,3-тригидроксибензол 1,2,4-тригидроксибензол 1,3,5-тригидроксибензол
Одноатомные фенолы
Способы получения
Природным источником фенола и его гомологов служит каменный уголь, при сухой перегонке которого образуется каменноугольная смола. При разгонке смолы получают фракцию «карболового масла» (t 0 160-230 0 С), содержащую фенол и крезолы.
1. Сплавление солей ароматических сульфокислот со щелочами
Реакция лежит в основе промышленных методов получения фенолов.
Реакция состоит в нагревании бензолсульфокислоты с твердой щелочью (NaOH, KOH) при температуре 250-300 0 С:
Реакция протекает по механизму нуклеофильного замещения S N 2 аром (присоединение-отщепление).
Присутствие электроноакцепторных заместителей в орто- и пара-положениях по отношению к месту замещения облегчает реакцию нуклеофильного замещения.
2. Гидролиз арилгалогенидов
Арилгалогениды, не содержащие активирующих электроноакцепторных заместителей, вступают в реакцию в очень жестких условиях.
Так, хлорбензол гидролизуется с образовнием фенола действием концентрированной щелочи при температуре 350-400 0 С и высоком давлении 30 МПа, либо в присутствии катализаторов – солей меди и высокой температуре:

Реакция протекает по механизму нуклеофильного замещения (отщепление-присоединение) (ариновый или кине-механизм).
Присутствие электроноакцепторных заместителей в орто- и пара-положениях по отношению к галогену значительно облегчает реакцию гидролиза.
Так, пара-нитрохлорбензол способен замещать хлор на гидроксил обычным нагреванием с раствором щелочи при атмосферном давлении:
 пара-нитрохлорбензол пара-нитрофенол
пара-нитрохлорбензол пара-нитрофенол
Реакция протекает по механизму S
N
2
аром
(присоединение-отщепление).
3. Получение фенола из кумола (кумольный способ)
Синтез на основе кумола имеет промышленное значение и ценен тем, что позволяет получать одновременно два технически важных продукта (фенол и ацетон) из дешевого сырья (нефть, газы крекинга нефти).
Кумол (изопропилбензол) при окислении кислородом воздуха превращается в гидропероксид, который под действием водного раствора кислоты распадается с образованием фенола и ацетона:
гидропероксид фенол ацетон
4. Гидроксилирование аренов
Для прямого введения гидроксильной группы в бензольное кольцо используют пероксид водорода в присутствии катализаторов (солей железа (П) или меди (П):
5. Окислительное декарбоксилирование карбоновых кислот
Фенолы получают из ароматических кислот пропуская в реактор водяной пар и воздух при температуре 200-300 0 С в присутствии солей меди (П):
6. Получение из солей диазония
При нагревании арендиазониевых солей в водных растворах выделяется азот с получением фенолов:
Физические свойства фенолов
Простейшие фенолы при обычных условиях представляют собой низкоплавкие бесцветные кристаллические вещества с характерным запахом.
Фенолы малорастворимы в воде, но хорошо растворимы в органических растворителях. При хранении на воздухе темнеют вследствие процессов окисления.
Являются токсичными веществами, вызывают ожоги кожи.
Электронное строение фенола
Строение и распределение электронной плотности в молекуле фенола можно изобразить следующей схемой:

Гидроксильная группа является заместителем 1 рода, т.е. электроно-донорным заместителем.
Это обусловлено тем, что одна из неподеленных электронных пар гидроксильного атома кислорода вступает в р,π-сопряжение с π-системой бензольного ядра, проявляя +М-эффект.
С другой стороны, гидроксильная группа, вследствие большей электроотрицательности кислорода, проявляет –I-эффект.
Однако +М-эффект в фенолах значительно сильнее противоположно направленного –I-эффекта (+М > -I).
Результатом эффекта сопряжения является:
1) увеличение полярности связи О-Н, приводящее к усилению кислотных свойств фенолов по сравнению со спиртами;
2) вследствие сопряжения связь С-ОН у фенолов становится короче и прочнее в сравнении со спиртами , так как носит частично двойной характер. Поэтому затрудняются реакции замещения ОН-группы;
3) повышение электронной плотности на атомах углерода в орто- и пара-положениях бензольного ядра облегчает реакции электрофильного замещения атомов водорода в этих положениях.

Химические свойства фенолов
Химические свойства фенолов определяются наличием в молекуле гидроксильной группы и бензольного кольца.
1. Реакции по гидроксильной группе
1. Кислотные свойства
Фенолы являются слабыми ОН-кислотами, но значительно более сильными по сравнению с алканолами. Константа кислотности рК а фенола равна 10.
Более высокая кислотность фенола объясняется двумя факторами:
1) большей полярностью связи О-Н в фенолах, в результате чего атом водорода гидроксильной группы приобретает большую подвижность и может отщепляться в виде протона с образованием фенолят-иона;
2) Фенолят-ион за счет сопряжения неподеленной пары кислорода с бензольным кольцом мезомерно стабилизирован, т.е. отрицательный заряд на атоме кислорода фенолят-иона значительно делокализован:

Ни одна из этих граничных структур в отдельности не описывает реального состояния молекулы, но их использование позволяет объяснять многие реакции.
Электроноакцепторные заместители увеличивают кислотные свойства фенола.
Оттягивая электронную плотность из бензольного ядра на себя, они способствуют усилению р,π-сопряжения (+М-эффект), тем самым повышают поляризацию связи О-Н и увеличивают подвижность атома водорода гидроксильной группы.
Например:
 фенол 2-нитрофенол 2,4-динитрофенол пикриновая кислота
фенол 2-нитрофенол 2,4-динитрофенол пикриновая кислота
рК а 9,98 7,23 4,03 0,20
Электронодонорные заместители уменьшают кислотность фенолов.
1. Замещение фенольного гидроксила галогеном
Гидроксильная группа в фенолах с большим трудом замещается галогеном.
При взаимодействии фенола с пентахлоридом фосфора PCl 5 основным продуктом является трифенилфосфат и лишь в небольших количествах образуется хлорбензол:
Трифенилфосфат хлорбензол
Присутствие электроноакцепторных заместителей в орто- и пара-положениях по отношению к гидроксилу намного облегчает реакции нуклеофильного замещения группы ОН.
Так, пикриновая кислота в тех же условиях легко превращается в 2,4,6-тринитрохлорбензол (пикрилхлорид): пикриновая кислота пикрилхлорид
пикриновая кислота пикрилхлорид
2. Взаимодействие с аммиаком
При взаимодействии с аммиаком при повышенной температуре и давлении в присутствии катализатора хлорида алюминия происходит замещение ОН-группы на NH 2 -группу с образованием анилина:
 фенол анилин
фенол анилин
3. Восстановление фенола
При восстановлении фенола алюмогидридом лития образуется бензол:
3. Реакции с участием бензольного кольца
1. Реакции электрофильного замещения в бензольном кольце
Гидроксильная группа является заместителем 1 рода, поэтому реакции электрофильного замещения в бензольном ядре протекают с фенолами значительно легче, чем с бензолом, а заместители направляются в орто- и пара-положения.

1) Реакции галогенирования
Фенол легко при комнатной температуре взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола:

2,4,6-трибромфенол
Эта реакция является качественной на фенолы.
Легко происходит хлорирование фенола:

2) Реакции нитрования
Фенол легко нитруется разбавленной азотной кислотой при температуре 0 0 С с образованием смеси орто- и пара-изомеров с преобладанием орто-изомера:
орто- и пара-нитрофенолы
Изомерные нитрофенолы легко разделяются благодаря тому , что только орто-изомер обладает летучестью с водяным паром.
Большая летучесть орто-нитрофенолов объясняется образованием внутримолекулярной водородной связи, в то время как пара-изомер образует межмолекулярные водородные связи:
При использовании концентрированной азотной кислоты образуется 2,4,6-тринитрофенол (пикриновая кислота):
 пикриновая кислота
пикриновая кислота
3) Реакции сульфирования
Фенол легко сульфируется при комнатной температуре концентрированной серной кислотой с образованием орто-изомера, который при температурах выше 100 0 С перегруппировывается в пара-изомер:

4) Реакции алкилирования
Фенолы легко вступают а реакции алкилирования.
В качестве алкилирующих агентов используют галогеналканы, алканолы и алкены в присутствии протонных кислот (H 2 SO 4 , H 3 PO 4) или кислот Льюиса (AlCl 3 , BF 3):

5) Реакции ацилирования
Легко происходит ацилирование фенолов под действием галоген-ангидридов или ангидридов карбоновых кислот в присутствии кислот Льюиса:
6) Реакции нитрозирования
Нитрозофенолы получают прямым нитрозированием фенолов:

пара-крезол орто-нитрозо-пара-крезол
7) Реакции азосочетания
Сочетание с фенолами ведут в слабощелочной среде
, так как фенолят-ион значительно активнее, чем сам фенол:

8) Реакции конденсации
Фенолы являются столь активными компонентами в реакциях электрофильного замещения , что вступают во взаимодействие с весьма слабыми электрофилами – альдегидами и кетонами в присутствии кислот и оснований.
Конденсация с формальдегидом
Наиболее легко вступает в реакции конденсации формальдегид.
Если реакцию конденсации фенола с формальдегидом проводить в мягких условиях, то удается выделить орто- и пара-гидроксиметилфенолы:Отдельные представители
Фенол – кристаллическое вещество с т. пл. 43°С, обладает характерным едким запахом, вызывает ожоги на коже. Это один из первых примененных в медицине антисептиков. Применяется в больших количествах для получения пластических масс (конденсация с формальдегидом), лекарственных препаратов (салициловая кислота и ее производные), красителей, взрывчатых веществ (пикриновая кислота).
Метиловый эфир фенола – анизол – применяется для получения душистых веществ и красителей.
Этиловый эфир фенола – фенетол .
Крезолы (метилфенолы) применяются в производстве пластических масс, красителей, дезинфицирующих средств.
Фенольный гидроксил – гидроксил, связанный с ароматическим циклом.
1. Кислотно–основные свойства обусловлены наличием в фенольном гидроксиле подвижного атома водорода. Электронная пара гидроксила смещена в сторону ароматического цикла, поэтому кислотные свойства более сильные, чем у спиртов. Так pKa угольной кислоты = 6,35, а pKa фенола = 9,89.
Фенолы растворяются в водных растворах щелочей с образованием фенолятов (феноксидов):
Однако кислотный характер фенолов выражен настолько незначительно, что даже такая слабая кислота как угольная, вытесняет фенолы из их солей:
Поэтому фенолы, растворяясь в щелочах, не могут растворяться в карбонатах, т.к. освобождающаяся при этом угольная кислота тотчас же разлагает фенолят:
Это свойство фенолов отличает их от карбоновых кислот.
При повышении температуры реакция идет в прямом направлении. Феноляты щелочных металлов, как соли сильных оснований и слабых кислот, частично гидролизованы в водных растворах, поэтому растворы фенолятов обладают щелочной реакцией.
2. Реакция этерификации (аналогично спиртовому гидроксилу).
Образование простых эфиров – реакция фенолятов и галоидных алкилов (или алкилсульфатов).
C 6 H 5 ONa+JCH 3 ®C 6 H 5 OCH 3 +NaJ
Сложные эфиры образуются при взаимодействии фенолятов натрия с ангидридами (или хлорангидридами кислот).
3. Окислительно – восстановительные свойства.
Фенолы проявляют сильные восстановительные свойства, очень легко окисляются даже слабыми окислителями, при этом образуются окрашенные соединения хиноидной структуры.
 | [О] – CaOCl 2 , H 2 O 2 , Cl 2 , Br 2 |
Примером реакции окисления является образование индофенолового красителя: образующийся хинон при взаимодействии с NH 3 превращается в хинонимин, который взаимодействует с не прореагировавшим фенолом. В присутствии аммиака образуется индофенол, окрашенный в синий цвет.

хинонимин индофенол
n- бензохинонимин
Разновидностью индофеноловой реакции является нитрозореакция Либермана, которая характерна для тех фенолов, у которых нет заместителей в орто- и пара-положениях .
При действии нитрита натрия в кислой среде образуется n -нитрозофенол, изомеризующийся в монооксим n -бензохинона, который затем, реагируя с избытком фенола в кислой среде, дает индофенол.

Наблюдается окрашивание, изменяющееся при добавлении раствора щелочи:
фенол – темно-зеленое, переходящее в вишнево-красное;
тимол – сине-зеленое, переходящее в фиолетовое;
резорцин – фиолетово-черное, переходящее в фиолетовое;
гексэстрол (синэстрол) – красно-фиолетовое, переходящее в вишневое.
4. Реакция комплексообразования с ионами железа.
В зависимости от количества фенольных гидроксилов, наличия в молекуле других функциональных групп, их взаимного расположения, pH среды, температуры, образуются комплексные соединения различного состава и окраски (исключение – тимол).



Комплексы окрашены:
фенол – синий цвет;
резорцин – сине-фиолетовый цвет;
кислота салициловая – сине-фиолетовый или красно-фиолетовый цвет;
осалмид (оксафенамид) – красно-фиолетовый цвет;
натрия пара-аминосалицилат – красно-фиолетовый цвет;
хинозол – синевато-зеленый цвет.
Реакция является фармакопейной для большинства фенольных соединений.
5. Реакции электрофильного замещения – S E атома водорода в ароматическом кольце (бромирование, конденсация с альдегидами, сочетание с солями диазония, нитрование, нитрозирование, йодирование и др.). Способность фенолов вступать в реакции электрофильного замещения объясняется взаимодействием неподеленной электронной пары атома кислорода с π-электронами бензольного кольца. Электронная плотность смещается в сторону ароматического кольца. Наибольший избыток электронной плотности наблюдается у атомов углерода в о- и n- положениях по отношению к фенольному гидроксилу (ориентанту I рода).
5.1. Реакция галогенирования (бромирование и йодирование).
5.1.1. При взаимодействии с бромной водой образуются белые или желтые осадки бромпроизводных.

При избытке брома происходит окисление:

Реакция бромирования фенолов зависит от природы и положения заместителей.
Аналогично происходит йодирование, например:

5.1.2. При наличии заместителей в о- и n- положениях ароматического кольца в реакцию вступают незамещенные атомы водорода ароматического кольца.

5.1.3. Если в о- и n- положениях по отношению к фенольному гидроксилу находится карбоксильная группа, то при действии избытка брома происходит декарбоксилирование:

5.1.4. Если соединение содержит два фенольных гидроксила в м- положении, то при действии брома образуются трибромпроизводные (согласованная ориентация):

5.1.5. Если две гидроксильные группы расположены по отношению друг к другу в о- или n- положениях, то реакция бромирования не протекает (несогласованная ориентация)

5.2. Реакции конденсации
5.2.1. С альдегидами.
Примером конденсации фенолов с альдегидами является реакция с реактивом Марки. При нагревании фенолов с раствором формальдегида в присутствии концентрированной H 2 SO 4 образуются бесцветные продукты конденсации, при окислении которых получаются интенсивно окрашенные соединения хиноидной структуры. Серная кислота играет в данной реакции роль дегидратирующего, конденсирующего средства и окислителя.

5.2.2. Реакция фенолов с хлороформом (CHCl 3) с образованием ауриновых красителей.
При нагревании фенолов с CHCl 3 в щелочной среде образуются аурины – трифенилметановые красители:

Аурины окрашены:
фенол – желтый цвет;
тимол – желтый цвет, переходящий в фиолетовый;
резорцин – красно-фиолетовый цвет.
5.2.3. С ангидридами кислот.
А. Реакция образования флуоресцеина (конденсация резорцина с фталевым ангидридом).


Б. Реакция образования фенолфталеина (конденсация фенола с фталевым ангидридом).

При большом избытке щелочи образуется трехзамещенная натриевая соль.
Конденсация тимола с фталевым ангидридом идет аналогично реакции образования фенолфталеина, образуется тимолфталеин, имеющий синее окрашивание в щелочной среде.
5.3. Реакция нитрования
Фенолы вступают в реакцию с разбавленной азотной кислотой (HNO 3) и образуют орто- и пара-нитропроизводные. Добавление раствора натрия гидроксида усиливает окраску вследствие образования хорошо диссоциированной соли.

5.4. Реакция азосочетания фенолов с солью диазония в щелочной среде.
При взаимодействии фенолов с солью диазония при pH 9-10 образуются азокрасители, окрашенные в желто-оранжевый или красный цвет. Реакция азосочетания протекает в орто- и пара-положениях по отношению к фенольному гидроксилу. В качестве диазореактива обычно применяют диазотированную сульфаниловую кислоту.


Введение
Большинство лекарственных средств, используемых в медицинской практике, являются органическими соединениями. Подлинность таких веществ подтверждают с помощью реакций на функциональные группы.
Функциональной группой называют реакционно-способный атом, группу атомов или реакционный центр в молекуле органического соединения.
Общим принципом функционального анализа является применение характерных реакций для групп, подлежащих определению. Реакция должна быть не только возможно более специфичной, но и достаточно быстрой, и в ней должны участвовать реагент или продукт реакции, легко поддающиеся определению.

Идентификация спиртового гидроксила
Спирты - это производные углеводородов, в молекулах которых один или несколько атомов водорода замещены гидроксильными группами. В общем виде молекулу спирта можно представить как ROH.
Реакция образования сложных эфиров
Спирты образуют с органическими кислотами или ангидридами кислот в присутствии водоотнимающих средств (например, серная кислота концентрированная) сложные эфиры. Сложные эфиры, полученные на основе низкомолекулярных спиртов, обладают характерным запахом, а сложные эфиры на основе высокомолекулярных спиртов являются кристаллическими веществами, имеющими четкую температуру плавления.
Методика. К 1 мл этанола прибавляют 5 капель ледяной уксусной кислоты, 0,5 мл концентрированной серной кислоты и осторожно нагревают; обнаруживается характерный запах этилацетата (свежих яблок).

Реакция окисления спиртов до альдегидов
Образующиеся альдегиды обнаруживают по запаху. В качестве окислителей используют калия гексациано - (Ш) - феррат, калия перманганат, калия дихромат и др.
Методика. В первую пробирку помещают 2 капли этанола, 1 каплю 10%-го раствора серной кислоты и 2 капли 10%-го раствора дихромата калия. Полученный раствор имеет оранжевую окраску . Нагревают его над пламенем, пока раствор не начнет приобретать синевато-зеленую окраску (одновременно ощущается характерный запах уксусного альдегида, напоминающий запах антоновских яблок). Вносят 1 каплю полученного раствора во вторую пробирку с 3 каплями фуксинсернистой кислоты. Появляется розово-фиолетовое окрашивание.
Реакция образования комплексных соединений
Многоатомные спирты образуют с сульфатом меди в щелочной среде (с реактивом Фелинга) комплексные соединения синего цвета.
Методика. К 0,5 мл глицерина прибавляют по 5 капель растворов натрия гидроксида и меди (II) сульфата, появляется интенсивное синее окрашивание.

Идентификация фенольного гидроксила
Реакция с железа (111) хлоридом
Характерной качественной реакцией на фенолы является реакция с железа (III) хлоридом. В зависимости от количества фенольных гидроксилов, наличия в молекуле фенола других функциональных групп, их взаимного расположения, рН среды, температуры, образуются комплексные соединения различного состава и окраски.
Методика. К 0,01 г. препарата, растворенного в 1 мл воды (для фенола, резорцина) добавляют 2 капли раствора железа (III) хлорида - наблюдается характерное окрашивание (табл. 1.).
Таблица 1. Окраска комплексов препаратов с железа (III) хлоридом
|
Препарат |
Растворитель |
Окраска комплекса |
|
Фиолетовая |
||
|
Резорцин |
Сине-фиолетовая |
|
|
Адреналина гидрохлорид |
Изумрудно-зеленое, переходящее от прибавления одной капли раствора аммиака в вишнево-красное, а затем в оранжево-красное. |
|
|
Морфина гидрохлорид |
Синее, исчезающее от прибавления разведенных уксусной или соляной кислот |
|
|
Парацетамол |
Сине-фиолетовое |
|
|
Пиридоксина гидрохлорид |
Красное, исчезающее от прибавления разведенной соляной кислоты и не исчезающее от разведенной уксусной кислоты. |
|
|
Салициловая кислота и натрия салицилат |
Сине-фиолетовое, не исчезающее от прибавления нескольких капель разведенной соляной или уксусной кислот. |
|
|
Фенилсалицилат |
Фиолетовое, исчезающее от прибавления разведенной соляной или уксусной кислот и переходящее в кроваво-красное от прибавления 1-2 капель раствора аммиака. |
С помощью раствора аммиака можно отличить фенол от резорцина. Окраска комплекса резорцина с железом после добавления реактива изменяется до буровато-желтой.